단축키
Prev이전 문서
Next다음 문서
단축키
Prev이전 문서
Next다음 문서
항전혈병 비타민인 비타민 C(아스코르빈산)는 인간과 다른 영장류에 의해 합성될 수 없으며 음식물을 통해 섭취해야 합니다. 아스코르브산은 전자 공여체이며 15가지 포유류 효소의 보조 인자 역할을 합니다. 두 개의 나트륨 의존성 수송체는 아스코르브산에 특이적이며, 산화 생성물인 데히드로아스코르브산은 포도당 수송체에 의해 수송됩니다. 아스코르브산은 대부분의 조직과 체액에 차별적으로 축적됩니다. 혈장 및 조직 비타민 C 농도는 섭취량, 생체 이용률, 신장 배설 및 활용도에 따라 달라집니다. 생물학적으로 의미가 있거나 임상적으로 관련성이 있으려면 비타민 C 작용에 대한 시험관 내 및 생체 내 연구가 비타민의 생리학적 농도를 고려해야 합니다. 이 논문에서는 비타민 C의 생리학을 검토합니다. 새로운 지식이 축적되었거나 이해가 제한된 비타민 C와 관련된 많은 현상; 답변해야 할 비타민에 관해 질문을 제기합니다. 유익할 가능성이 있는 일련의 조사를 탐색합니다.
소개
비타민 C(아스코르브산, 약어로 AA; 비타민 C와 아스코르브산이라는 용어는 같은 의미로 사용됨)는 모든 식물과 대부분의 동물에서 합성됩니다( Smirnoff et al., 2001 ). AA 합성 경로의 말단 효소인 굴로노락톤 산화효소의 유전자가 돌연변이를 겪어 기능을 하지 못하게 되었기 때문에 이는 인간을 위한 비타민입니다( Linster & Van Schaftingen, 2007 ). 아스코르빈산 합성 능력을 상실한 동물은 서로 계통발생적 관계를 갖지 않습니다. 이러한 동물에는 인간이 아닌 영장류, 기니피그, 카피바라 및 일부 새와 물고기가 포함됩니다( Chaudhuri & Chatterjee, 1969 , Chatterjee, 1973 , Cueto et al., 2000 ). 아스코르빈산이 부족하면 괴혈병이라는 치명적인 질병이 발생하는데, 이 괴혈병은 비타민 C를 투여해야만 치료할 수 있습니다.
이 논문에서 우리는 인간 건강과 관련된 비타민 C 생물학의 일반적인 측면을 검토합니다. 다른 곳에서 광범위하게 검토된 비타민 C의 측면은 여기서는 간략하게만 논의됩니다. 여기에는 비타민 C 측정이 정확하고 정밀하도록 보장하기 위한 적절한 시료 처리 및 분석 신뢰성의 중요성이 포함됩니다( Levine et al., 1999b ). 항산화제로서 비타민 C의 역할( Padayatty et al., 2003 ); 그리고 약리학적(고용량) 정맥 투여된 비타민 C의 화학 및 생물학( Levine et al., 2011 )( Parrow et al., 2013 ). 수많은 역학 및 개입 연구에서 비타민 C 섭취 및/또는 보충이 생리적 매개변수, 바이오마커 및 임상적 종말점에 미치는 영향을 조사했습니다. 일반적으로 이러한 연구에서는 비타민 C 섭취로 인한 효과가 없거나 모호한 결과가 보고되었습니다. 비록 이러한 결과가 여기에서 자세히 검토되지는 않지만 연구 설계 및 해석에 있어서 용량 농도 관계의 중요성을 강조합니다. Goldilocks가 명확하게 설명했듯이 "적절한" 농도와 양을 얻는 방법은 전체적으로 논의됩니다. 첨부된 그림과 그림 설명은 대부분 자립적이며, 원고 내 그림 자료의 반복은 최소화됩니다.
괴혈병의 역사와 비타민C의 발견
괴혈병은 고대부터 알려져 있었지만( Clmeston, 1989 ), 지난 500년 동안 대규모 사망의 주목할만한 원인이 되었습니다. 괴혈병은 특히 겨울과 공성전 중에 북유럽의 대규모 지상군과 도시를 괴롭혔습니다. 탐험 시대에는 괴혈병이 바다 항해를 제한하는 주요 요인이 되었고, 바다에서 2~3개월 후에 많은 선원이 사망하는 경우가 많았습니다. 아마도 최초의 대조 임상 시험에서 James Lind는 괴혈병이 감귤류에 의해 치료될 수 있음을 보여주었습니다( Lind, 1953b ). 그러나 이 간단한 치료법은 수십 년 동안 널리 사용되지 않았습니다. 이번 발견은 현존하는 과학적 지식과 맞지 않았고, 질병의 원인에 관한 기존 이론에는 영양결핍에 대한 개념도 없었다. 아스코르브산은 1928년 Albert Szent-Gyorgyi에 의해 처음 분리되었으며 1932년 Szent-Gyorgyi와 King에 의해 항괴혈병 인자로 밝혀졌습니다( Svirbely & Szent-Gyorgyi, 1932 , King & Waugh, 1932 ).
괴혈병
괴혈병의 초기 증상은 미미하며, 제임스 린드(James Lind)는 괴혈병에 관한 그의 논문(1753)에서 무기력함( Lind, 1953b )으로 기술했습니다. 바다에서 한두 달 있다가 병에 걸린 선원들에게는 예견된 고통이었다. 선원들은 초기 단계에서 주도권과 작업 의욕을 잃었지만, 강제로 작업을 하게 되면 정상적으로 작업할 수 있었습니다. 프랭크 괴혈병은 현재 드물지만 완전한 형태에서는 눈에 띄는 징후와 증상이 나타납니다. 여기에는 건강염려증과 우울증이 포함됩니다. 꼬인 털을 동반한 모낭주위 과각화증; 부어오르고 부서지기 쉬운 치은; 빈혈, 점상출혈, 홍반 및 자반병; 관절통 및/또는 관절 삼출물; 오래된 상처의 붕괴; 피부, 피하 조직, 근육, 관절 및 골막하 출혈로의 출혈; 발열; 호흡 곤란; 감염; 그리고 혼란( Hodges et al., 1971 , Hood et al., 1970 ). 피험자는 일부 증상이나 징후만 나타낼 수 있으며, 이러한 경우 초기에 진단을 놓치는 경우가 많습니다( Bernardino et al., 2012 ). 여러 비타민 결핍이 있거나( Blanchard et al., 2014 ) 호흡 곤란과 같은 비정형 증상이 우세할 때( Kupari & Rapola, 2012 ) 임상 양상은 혼란스럽습니다. 치료하지 않으면 상태는 치명적입니다.
괴혈병이 발생하는 확실한 낮은 비타민 C 혈장 농도는 없습니다. 방사성 표지된 비타민 C를 사용한 연구에 따르면 건강한 사람의 체내 저장량은 약 1500mg입니다. 괴혈병은 혈장 비타민 C 농도가 10μM 미만일 때 이 농도가 300mg 미만으로 떨어지면( Hodges et al., 1971 ) 발생하는 것으로 생각됩니다 . 그러나 이러한 실험은 비타민C 측정이 비타민C뿐만 아니라 기타 알려지지 않은 간섭 물질을 검출하는 비색 분석법을 사용하던 시기에 수행되었습니다. 비타민 C의 과대평가는 측정된 비타민 C의 농도가 낮을 때 더욱 두드러졌습니다( Baker et al., 1969 , Baker et al., 1971 , Hodges et al., 1971 ). 현대의 비타민 C 분석법은 훨씬 더 정확하고 정밀합니다. 이들은 일반적으로 비타민C를 다른 물질로부터 분리하기 위해 고성능 액체 크로마토그래피(HPLC)를 사용하고, 비타민C를 검출하고 측정하기 위해 흐름 전기화학(전류법), 흐름 전기화학(전량법), 자외선(UV) 또는 형광을 사용합니다. 최근에는 질량 분석법은 액체 크로마토그래피(LC-MS라고 함)와 결합된 비타민 C를 검출하는 또 다른 도구입니다( Leveque et al., 2000 , Szultka et al., 2014 , Gentili et al., 2008 ). 현재 가장 철저하게 특성화된 방법은 전기화학적 검출을 갖춘 HPLC이다( Levine et al., 1999b ). 따라서 부정확한 분석으로 인해 괴혈병의 혈장 비타민 C 농도 측정은 실제 값보다 2~3배 더 높은 값을 나타낼 수 있습니다. 최신 HPLC 전기화학적 분석을 활용한 고갈-고갈 연구에서 건강한 젊은 남성과 여성은 괴혈병이 발생하지 않고 혈장 비타민 C 농도가 8μM에 도달했습니다( Levine et al., 1996b , Levine et al., 2001b ). 그러나 많은 피험자들은 무기력함을 경험했으며 비타민 C를 더 고갈시키는 것은 안전하지 않은 것으로 간주되었습니다. 따라서 괴혈병은 낮은 혈장 비타민 C 농도로 확인되는 임상 진단으로 남아 있지만 아직 명확한 진단 농도는 없습니다. 10μM 미만의 값은 초기 괴혈병과 크게 다르지 않지만 물리적 징후는 훨씬 낮은 값, 즉 3-5μM에서만 나타날 수 있습니다. 역학 연구에서 혈장 비타민 C 농도가 11.4μM(0.2mg/dl) 미만이면 결핍을 나타내는 것으로 간주됩니다( Jacob et al., 1987 , Schleicher et al., 2009 ).
비타민C의 화학과 대사
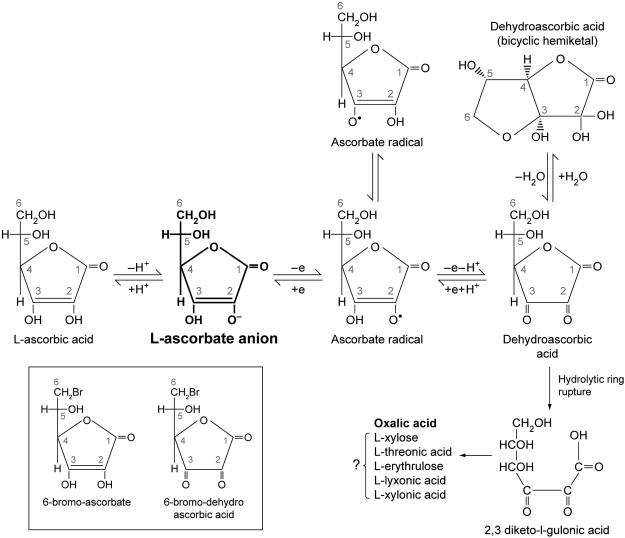
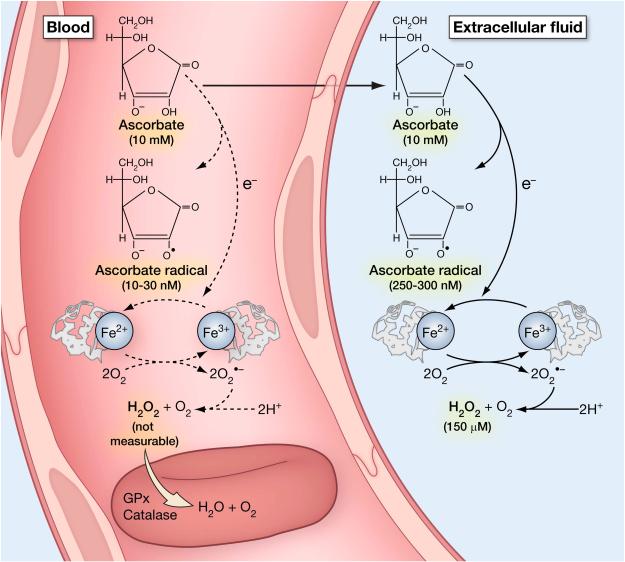
화학적으로 비타민 C는 전자 공여체 또는 환원제이며, 아스코르베이트의 전자는 알려진 모든 생리학적 효과를 설명합니다. 비타민C의 화학작용은 다음에 자세히 설명되어 있습니다.그림 1. 비타민 C의 전자는 산화된 종, 즉 산화제를 감소시킬 수 있기 때문에 비타민 C는 종종 항산화제라고 불리지만 이 용어는 오해의 소지가 있습니다. 아스코르브산염의 전자는 구리 및 철과 같은 금속을 환원시켜 과산화물 및 과산화수소를 형성하고 이후 반응성 산화종을 생성할 수 있습니다. 따라서 어떤 상황에서는 아스코르베이트가 환원제로서의 작용을 통해 산화제를 생성합니다. 이 화학은 밀리몰 범위의 약리학적 아스코르베이트 농도가 혈장 및 세포외액에서 달성될 때 생체 내 에서 발생하며, 금속이 존재할 때 세포 배양 배지에서 아스코르베이트의 생리학적 농도에서도 발생할 수 있습니다( Parrow et al., 2013 ).
Ascorbate는 순차적으로 전자를 잃습니다. 하나의 전자가 손실되면 첫 번째 생성물은 아스코르베이트 라디칼입니다. 대부분의 급진적인 종은 1밀리초 미만의 짧은 수명을 가집니다. 아스코르베이트 라디칼은 산소와 전자 수용체, 특히 철의 부재에 따라 반감기가 몇 초 또는 심지어 몇 분이 될 수 있다는 점에서 다릅니다( Buettner, 1993 ). 예를 들어, 일부 조건에서는 혈액 및 세포외액 시료에서 아스코르베이트 라디칼이 측정될 수 있습니다( Chen et al., 2007 ). 두 번째 전자가 손실되면 아스코르베이트 자유 라디칼에 비해 더 안정적인 종이 형성됩니다. 형성된 종은 수화 및 무수 형태로 존재하는 데히드로아스코르브산입니다. 아래에 논의된 바와 같이, 데히드로아스코르빈산은 촉진된 포도당 수송체에 대한 친화성을 가지며 다수의 이들에 의해 수송됩니다( Corpe et al., 2013 )( Rumsey et al., 1997 )( Rumsey et al., 2000a ). 디하이드로아스코르브산과 아스코르베이트 라디칼은 모두 가역적으로 아스코르베이트로 환원됩니다. Dehydroascorbic acid 반감기는 가수분해 고리 파열로 인해 단 몇 분입니다. 고리 구조가 손실되면 생성물 2,3 디케토굴론산은 전구체인 데히드로아스코르브산, 아스코르베이트 라디칼 및 아스코르베이트를 재형성할 수 없습니다.
비타민 C의 알려진 작용과 가정된 작용
효소학과 비타민C
위에서 설명한 바와 같이, 비타민 C의 모든 알려지거나 가정된 작용은1 번 테이블AA는 전자 공여체이므로 환원제라는 단일 화학적 특성으로 설명됩니다. 가장 잘 특성화된 작용은 실제 보조 기질인 작용을 포함하여 효소 보조 인자로서의 작용입니다. 아스코르베이트는 15개의 포유류 효소와 3개의 곰팡이 효소에 대한 전자 공여체 역할을 합니다( Englard & Seifter, 1986 , Levine, 1986 ). 여기에는 2개의 모노옥시게나제(도파민 β-하이드록실라제, 펩티딜글리신 α-아미드화 모노옥시게나제), 12개의 디옥시게나제(6개의 프롤릴 4-하이드록실라제, 프롤릴 3-하이드록실라제, 리실 하이드록실라제, 아스파라기닐 하이드록실라제, 트리메틸라이신 하이드록실라제, γ-부티로베타인 하이드록실라제, 4-하이드록시페닐피루)가 포함됩니다. vate Dioxygenase ) 및 하나의 아민 산화효소. 이러한 효소 반응과 아스코르베이트의 역할에 대한 세부 사항은 다른 곳에서 설명되어 있지만( Levine et al., 2006 ) 간략한 요약은 다음과 같습니다.
신경분비 소포와 부신 크롬친화과립에서 발견되는 도파민 β-히드록실라아제( Levine et al., 1941b )는 신경계와 부신에서 노르에피네프린의 합성에 필요합니다. 이는 분자 산소와 아스코르브산염을 필요로 하며( Levine et al., 1941b ), 반응에는 아스코르브산염이 소모됩니다( Fleming & Kent, 1991 , Stewart & Klinman, 1988 ). 분비 소포에서 발견되는 펩티딜글리신 α-아미드화 모노옥시게나제는 많은 펩타이드 호르몬을 아미드화하여( Eipper & Mains, 1991 , Glembotski, 1986 )( Prigge et al., 2000 )( Kumar et al., 2015 ) 생물학적 활성을 만드는 데 필요합니다. 여기에는 많은 시상하부 및 위장 호르몬이 포함됩니다. 효소는 분자 산소, 구리 및 아스코르브산염을 필요로 하며, 아스코르브산염을 소비합니다( Prigge et al., 2000 ). 그러나 아미드화의 경우 다른 전자 공여체가 시험관 내에서 아스코르베이트를 대체할 수 있습니다 ( Prigge et al., 2000 ). 트리메틸라이신 하이드록실라제 및 γ-부티로베타인 하이드록실라제는 필수 아미노산인 라이신과 메티오닌으로부터 카르니틴을 합성하는 데 필요합니다. 효소에는 철, α-케토글루타레이트 및 환원제가 필요하며, 적어도 시험관 내에서는 아스코르베이트가 가장 최적입니다 ( Dunn et al., 1984 ). 카르니틴은 음식을 통해 얻어지며 체내에서도 합성되기 때문에 이 두 가지 공급원의 상대적 중요성과 카르니틴 합성에서 아스코르베이트의 역할을 생체 내에서 특성화하기가 어렵습니다 ( Thoma & Henderson, 1984 , Englard & Seifter, 1986 )( Rebouche , 1991a , 르부슈, 1991b ). 4-하이드록시페닐피루베이트 디옥시게나제는 티로신의 이화작용에 필요합니다( Lindblad et al., 1970 ). 아스코르브산염 결핍은 티로신 이화작용의 장애와 티로신의 혈장 농도 증가를 초래합니다( Englard & Seifter, 1986 , Levine et al., 1941a ).
아스코르베이트가 프롤릴 또는 리실 수산화에 관여하는 효소의 경우, 아스코르베이트는 보조기질이 아닌 보조인자로 작용합니다. 보조인자로서 생성된 생성물 분자의 수는 활용된 아스코르베이트 분자의 수에 비해 훨씬 많습니다. 프롤릴 4 수산화효소에는 콜라겐 수산화에 관여하는 3개의 동위효소와 HIF-1의 수산화에 다른 3개가 관여한다는 점에 유의하십시오( Pekkala et al., 2003 )( Myllyharju, 2008 ).
콜라겐 수산화
괴혈병의 일반적인 증상으로는 상처 열개, 상처 치유 불량, 치아 느슨함 등이 있으며, 이는 모두 결합 조직의 결함을 나타냅니다( Lind, 1953a )( Crandon et al., 1940 , Hirschmann & Raugi, 1999 ). 콜라겐은 결합 조직에 구조적 강도를 제공합니다. 비타민 C는 프로콜라겐의 번역 후 변형을 효소적으로 촉매하여( Peterkofsky, 1991 ) 콜라겐 생성 세포에 의해 적절한 양의 구조적으로 정상적인 콜라겐을 생성하고 분비합니다( Kivirikko & Myllyla, 1985 )( Prockop & Kivirikko, 1995 ). 소포체에서 합성되는 프리콜라겐은 프롤린이 풍부한 아미노산 반복으로 구성됩니다. 특정 프롤릴 및 라이실 잔기는 하이드록실화되고, 프롤린은 3-하이드록시프롤린 또는 4-하이드록시프롤린으로 전환되며, 라이신은 하이드록시라이신으로 전환됩니다. 프롤릴 3-수산화효소, 프롤릴 4-수산화효소 및 리실 수산화효소에 의해 촉매되는 반응( Peterkofsky, 1991 )( Prockop & Kivirikko, 1995 )( Pekkala et al., 2003 )에는 보조인자로서 비타민 C가 필요합니다. 수산화는 골지체로 운반되어 결국 분비 과립에 의해 분비되는 콜라겐의 안정적인 삼중 나선형 구조의 형성을 돕습니다. 수산화가 없으면 프로콜라겐의 분비가 감소하고( Peterkofsky, 1991 ) 아마도 더 빠른 분해를 겪게 될 것입니다. 그러나 일부 수산화는 비타민 C가 없더라도 발생할 수 있습니다( Parsons et al., 2006 ). 분비된 프로콜라겐은 효소적으로 분해되어 세포외 공간에서 자발적으로 콜라겐 원섬유를 형성하는 트로포콜라겐을 형성합니다. 이러한 원섬유는 분자간 콜라겐 교차 결합을 형성하여 콜라겐에 구조적 강도를 부여합니다. 수산화에 대한 효과와는 별도로 아스코르베이트는 콜라겐 합성을 자극할 수 있습니다( Geesin et al., 1988 )( Sullivan et al., 1994 ). 괴혈병 동물에서는 콜라겐 합성이 감소할 수 있습니다( Peterkofsky, 1991 , Kipp et al., 1996 , Tsuchiya & Bates, 2003 ). 감소된 콜라겐 교차 결합은 기니피그의 비타민 C 결핍의 지표일 수 있지만( Tsuchiya & Bates, 2003 ) 이는 비타민 C 결핍에만 국한되지 않을 수 있습니다. 인간 괴혈병의 많은 특징은 결합 조직의 약화로 인한 것으로 보이지만 이러한 병변이 콜라겐 합성 결함으로 인한 것인지는 밝혀지지 않았습니다.
HIF-1 수산화
비타민 C는 콜라겐의 하이드록실화 역할 외에도 별도의 프롤릴 4 하이드록실라제 세트에 의해 저산소증 유도 인자-1 알파(HIF-1α)의 특정 프롤린 잔기의 하이드록실화에도 역할을 할 수 있습니다. 이들 효소는 비헴철을 함유하고 있으며 아스코르베이트, 분자 산소 및 2-옥소글루타레이트를 필요로 합니다( Bruick & McKnight, 2001 ) ( Myllyharju, 2003 ) ( Pekkala et al., 2003 ) ( Knowles et al., 2003 ) ( Dengler et al ., 2014 ). HIF-1은 다세포 동물에서 산소 감지의 핵심인 전사 인자입니다( Taabazuing et al., 2014 )( Semenza, 2014 ). 이는 산소 조절 α 서브유닛과 구성적으로 발현되는 β 서브유닛으로 구성됩니다( Dengler et al., 2014 ). 정상적인 산소 장력을 포함한 정상적인 조건에서 HIF-1α는 특정 프롤린 및 아스파라긴 잔기에서 수산화됩니다. Hydroxylated HIF -1 α는 프로테아좀에 의한 분해를 목표로 합니다( Dengler et al., 2014 ). 저산소 상태에서는 대기 산소 감소 또는 국소 허혈로 인해 수산화가 억제되고 HIF-1α가 안정화됩니다. 금속이 이 시스템에 다른 영향을 미칠 수도 있지만 배양된 세포에서 금속 유도 아스코르베이트 고갈은 수산화를 억제하고 HIF-1 α를 안정화시킵니다( Kaczmarek et al., 2007 ). 수산화되지 않은 HIF-1α는 안정적이기 때문에 핵으로 이동할 수 있을 만큼 오랫동안 축적됩니다. 핵에서 HIF-1α는 HIF-1β와 이량체를 형성하고 이 이량체는 DNA와 결합하여 표적 유전자를 전사한다( Dengler et al., 2014 ). 관류된 폐에서 HIF-1 α는 저산소증에 의해 1시간 만에 유도되었지만 정상산소 조건에서는 몇 분 만에 분해되었습니다( Yu et al., 1998 ). HIF-1은 시스 작용 조절 요소 인 저산소증 반응 요소 내의 DNA 일부에 결합하여 유전자 전사를 활성화합니다 . HIF-1은 수백 개의 유전자를 조절할 수 있지만, 조절은 각 세포 유형에 대해 더 적은 수의 특정 유전자로 제한됩니다( Semenza, 2011 )( Taabazuing et al., 2014 ). HIF-1은 정상적인 생리학에서 중요한 역할을 합니다( Semenza, 2011 ). 다른 곳에서 검토한 바와 같이, HIF-1은 적혈구 생성을 조절하는 역할을 합니다( Franke et al., 2013 ). 폐질환( Shimoda & Semenza, 2011 ); 심장병( Semenza, 2014 ); 당뇨병( Catrina, 2014 , Ichiki & Sunagawa, 2014 ); 그리고 암( Semenza, 2013 )( Borsi et al., 2015 ). 이러한 모든 조건에는 조직 수준에서 다양한 정도의 산소 결핍이 있습니다. Ascorbate는 HIF-1에 입증 가능한 효과를 가지고 있습니다. 시험관 내 . 아스코르베이트는 세포 배양에서 HIF-1 활성을 억제하고 HIF-1 자극에 특이적인 유전자 전사를 예방했습니다( Vissers et al., 2007 , Kuiper et al., 2014 ). 건강한 피험자(아스코르베이트 및 철분이 풍부한)에서 저산소증에 의해 유발된 수축기 폐동맥압 증가는 비타민 C 정맥 투여에 영향을 받지 않았지만 철분 주입에 의해 감소되었습니다( Talbot et al., 2014 ). HIF가 저산소증으로 인한 폐고혈압의 매개자로 생각되지만 이러한 효과가 HIF-1에 의해 매개되는지 여부는 알려져 있지 않습니다( Shimoda & Laurie, 2014 ).
HIF-1은 FIH(Factor Inhibiting HIF)에 의해 부정적으로 규제됩니다. FIH는 아스코르베이트도 필요로 하는 수산화효소입니다( Flashman et al., 2010 ). FIH는 HIF 1 및 구조 단백질 안키린의 아스파라긴 및/또는 아스파르트산염 잔기의 수산화에 필요한 것으로 보입니다. 시험관 내 하이드록실화는 전자 공여체인 아스코르베이트 또는 아스코르베이트 유사체에 의존적이었습니다( Yang et al., 2011b ). 다른 세포내 전자 공여체가 충분한지는 알려지지 않았습니다. 글루타티온. HIF-1의 조작과 그 효소 경로에 관련된 인자는 매력적인 치료 목표를 제시할 수 있습니다( Myllyharju, 2008 ). HIF-1을 통해 잠재적으로 작용할 수 있는 인간 생리학 및 질병 상태에서 생체 내 아스코르베이트의 농도 의존적 역할은 아직 알려져 있지 않습니다.
생체내 및 현장에서의 효소학
많은 효소에 대한 보조 인자 또는 보조 기질로서 비타민 C의 역할은 생체 내에서 잘 연구되지 않았습니다 . 비타민 C만이 생체 내에서 이러한 역할을 수행할 수 있다는 것도 확실하지 않습니다 . 다양한 범위에서 다른 환원제가 아스코르베이트를 대체할 수 있습니다. 괴혈병의 일부 징후와 증상은 비타민 C가 역할을 하는 것으로 알려진 효소 작용의 특정 결함으로 인해 발생하는 것으로 보입니다. 무기력함과 자율신경 기능 장애의 징후는 노르에피네프린 생합성 장애로 인해 발생할 수 있습니다. 상처의 파괴, 치은 출혈, 치아의 풀림 및 기타 결합 조직의 명백한 결함은 콜라겐의 수산화 반응 장애로 인해 더 적은 양의 기능성 콜라겐이 생성되거나 더 약한 콜라겐 또는 두 가지 모두로 인해 발생할 수 있습니다. 펩타이드 호르몬의 손상된 아미드화( Eipper et al., 1992 )는 광범위한 호르몬 결함을 생성할 수 있지만 그러한 특정 결함이 인간이나 동물 괴혈병의 원인인 것으로 실험적으로 밝혀지지 않았습니다.
비타민 C가 보조인자로 작용하는 대부분의 효소 반응에는 정상적인 생체 내 농도 에 비해 상대적으로 낮은 농도의 비타민이 필요합니다 . 비타민 C 수송체 활동의 결과로 많은 조직에는 결핍에도 불구하고 상당한 양의 비타민 C가 포함되어 있을 수 있지만 인간에서는 그러한 측정이 가능하지 않습니다. 또한, 비타민 C의 세포내 분포에 관한 데이터는 제한적입니다. 괴혈병의 경우 세포 전체가 상당한 양의 비타민을 함유할 수 있지만 세포 내 특정 효소 반응 부위, 즉 세포 내 특정 효소 반응 부위에서 필요한 농도로 이용 가능하지 않을 수 있습니다. 특정 세포내 소기관 내. 아스코르베이트 농도가 효소 반응에 어떻게 영향을 미칠 수 있는지에 대한 한 가지 예는 노르에피네프린 생합성입니다. 아스코르베이트의 농도는 노르에피네프린 생합성 부위인 부신 수질 크롬친화과립에서 약 12-15 mM입니다. 도파민에서 노르에피네프린을 생산하는 효소는 도파민 베타-일산화효소(dopamine beta-monoxygenase)입니다. 아스코르베이트에 대한 이 효소의 Km은 1 mM 미만입니다. 이는 심각한 아스코르베이트 결핍이 발생하지 않는 한 이 효소가 최대 속도에 가깝게 작동한다는 것을 의미합니다( Dhariwal et al., 1989 )( Dhariwal et al., 1991a ). 괴혈병에서 부신 비타민 C가 너무 고갈되어 부신 수질 분비 과립의 농도가 1 mM 미만인지는 알려져 있지 않습니다.
세포 내 비타민 C가 효소의 보조 인자와는 다른 추가적인 역할을 할 수도 있습니다. 예를 들어, 아스코르베이트는 세포내 화학적 환원제(항산화제)로 작용할 수 있습니다. 이러한 반응 중 일부는 시험관 내에서 입증되었지만 임상적 관련성이 있는지 여부는 알려져 있지 않습니다. 글루타티온은 또 다른 세포내 환원 물질로, 종종 밀리몰 농도로 존재합니다( Montero et al., 2013 , Wu et al., 2004 ). 아스코르베이트를 전자 공여체로 활용하지만 글루타티온을 활용하지 않는 특정 세포 내 비효소 화학 반응이 있는지 여부는 알려져 있지 않습니다.
아스코르브산 및 데히드로아스코르브산 수송
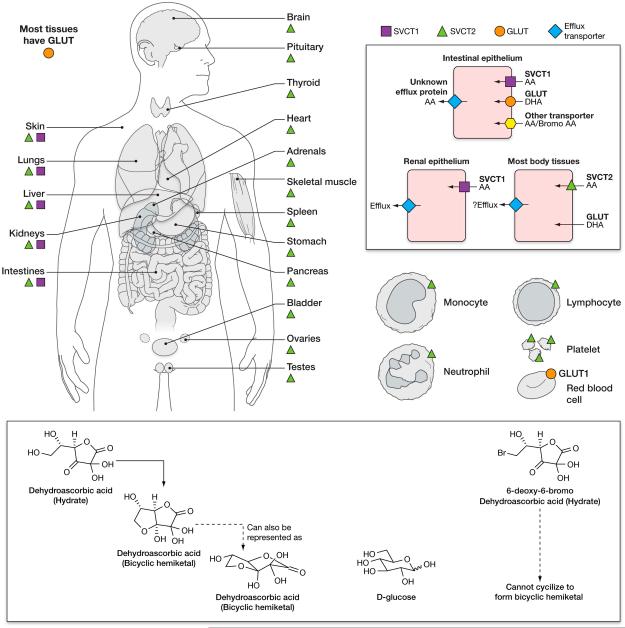
비타민 C는 나트륨 의존성 비타민 CT 수송체(SVCT) 1 및 2( Tskaguchi et al ., 1999 )( Daruwala et al., 1999 , Wang et al., 1999 , Wang et al., 2000 ). 동물과 인간에서 이러한 수송체의 분포는 두 수송 단백질의 mRNA 발현을 연구하여 결정되었습니다. 항체가 이용 가능하더라도 그 신뢰성은 일관되지 않았습니다. 기능적 연구에서는 세포 및 동물 모델을 사용하여 특정 조직에서 이러한 수송체의 역할을 명확히 했습니다. SVCT1과 2는 진화를 통해 고도로 보존된 핵염기 수송체 계열에 속합니다.
SVCT1은 흡수성 비타민 C 수송체이며 장, 신장 세뇨관 및 간에서 발생합니다.그림 2). 운반체가 발현되지 않는 SVCT1 녹아웃 마우스는 야생형 마우스에 비해 소변에서 다량의 비타민 C를 손실합니다. 소변 손실은 SVCT1이 결여되어 사구체에서 여과되는 비타민 C가 재흡수되지 않기 때문에 발생합니다( Corpe et al., 2010 ). 그러나 SVCT1 녹아웃 마우스는 장 내강에서 비타민 C 자체와 구조적 유사체인 6-브로모 아스코르베이트를 모두 흡수합니다. 아래에 자세히 설명된 바와 같이 산화된 6-브로모 아스코르베이트는 포도당 운반체(GLUT)에 의해 운반되지 않으며 SVCT1 녹아웃 마우스에는 SVCT1 운반체가 없습니다. 따라서 이 쥐는 SVCT2 또는 알려지지 않은 수송체를 통해 장 내강에서 AA와 6-브로모 아스코르베이트를 운반합니다.
비타민 C 수송 메커니즘을 연구하는 또 다른 방법은 SVCT2 녹아웃 마우스를 만드는 것이었습니다. SVCT2는 널리 분포되어 있으며 mRNA 발현에 기초하여 비타민 C의 주된 조직 수송체입니다. SVCT2 녹아웃 마우스는 출생 시 사망하며 태아 조직은 측정된 모든 조직에서 매우 낮은 비타민 C 농도를 나타냅니다( Sotiriou et al., 2002 ).
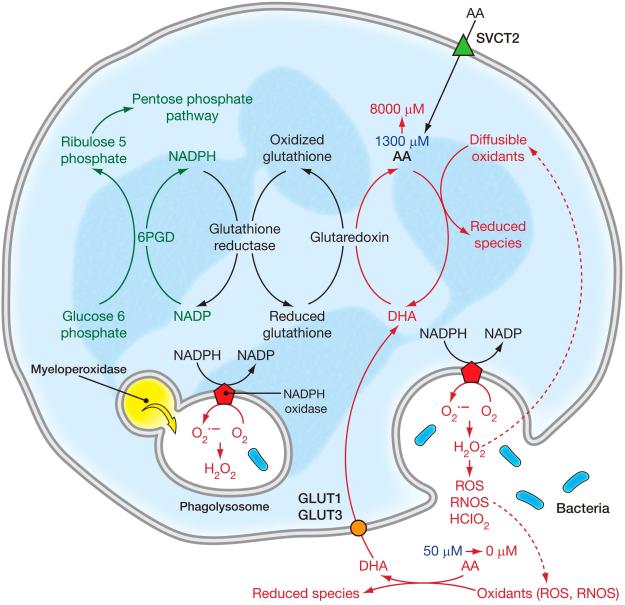
위에서 언급한 바와 같이, 아스코르브산염 산화 생성물인 DHA(dehydroascorbic acid)는 여러 가지 다른 형태로 존재하며 GLUT에 의해 운반됩니다( Corpe et al., 2013 )( Rumsey et al., 1997 )( Rumsey et al., 2000a , Vera et al. ., 1993 ). 몇몇 GLUTS는 포도당보다 DHA에 대한 친화력이 더 높습니다. DHA의 수화된 형태는 이환식 헤미케탈 구조를 형성하며, 그 중 일부는 3차원적으로 포도당과 유사합니다.그림 2) ( Corpe et al., 2005 ). DHA는 운반되자마자 즉시 세포 내에서 아스코르베이트로 환원됩니다. DHA로의 세포외 산화 과정, DHA 수송 및 즉각적인 세포내 환원 과정을 아스코르베이트 재활용이라고 합니다( Washko et al., 1993 ). 시험관 내 세포 모델 의 데이터를 기반으로 DHA는 아스코르베이트 축적을 위한 대체 경로 또는 우성 경로 역할을 하는 것으로 제안되었습니다( Vera et al., 1993 )( Nualart et al., 2003 )( Agus et al., 1997 ) .
생체 내 에서 손상되지 않은 유기체의 비타민 C 경제에서 DHA와 GLUT의 역할에 대한 우리의 이해는 특히 인간의 경우 불분명합니다. 이용 가능한 데이터에 따르면 DHA 수송이 대부분의 조직에서 아스코르베이트 수송의 주요 경로일 가능성은 낮습니다. 이는 SVCT2 녹아웃 마우스가 출생 시 사망하고 아스코르베이트가 합성되는 간 이외의 측정된 모든 조직에 아스코르베이트가 사실상 없기 때문입니다( Sotiriou et al., 2002 ). GLUT를 통한 DHA 수송이 회수 경로 역할을 할 수 있다면 아스코르베이트는 적어도 일부 조직에 존재해야 합니다. 생쥐는 인간과 다르기 때문에 인간에게는 생쥐가 부족한 DHA 경로가 있을 가능성이 여전히 남아 있습니다. 또한 SVCT2 녹아웃 마우스에서 모든 조직에서 아스코르베이트가 측정되지 않았으며 일부 조직이 아스코르베이트 재활용 경로를 활용할 가능성이 있습니다. 최근 사례는 쥐와 인간의 적혈구 실험에서 나왔습니다( Tu et al., 2015 ). 적혈구는 데히드로아스코르브산을 수송 기질로 독점적으로 활용하는 세포 유형 중 하나입니다. 적혈구 내부로 이동한 후 데히드로아스코르빈산은 즉시 비타민 C로 환원됩니다.
생리학적 상태에서 혈장 내 DHA 양은 아스코르베이트 양의 1~2% 미만으로 추정됩니다. 가까운 미래에 액체 크로마토그래피 질량 분석법을 사용하면 혈장에서 DHA를 직접 측정할 수 없는 현재의 무능력을 해결할 수 있을 것입니다. 이러한 분석은 생물학적 유체인 혈장의 DHA 불안정성과 가수분해를 설명해야 하며, 가수분해를 수정하거나 샘플 안정성을 제공해야 합니다. 현재 DHA를 정확하게 측정할 수 있는 직접적인 수단은 없습니다. 현재 기술은 아스코르베이트를 측정한 다음 샘플을 감소시킨 후 아스코르베이트를 다시 측정하는 것입니다. 감소 전 값에서 감소 후 값을 뺍니다. 일반적으로 큰 수에서 큰 수를 빼서 결과 차이가 0과 구별되지 않을 수 있으므로 정확도가 감소합니다. 아스코르베이트 산화가 국소적으로 일어나는 조건에서는 DHA 농도가 추정된 1-2% 혈장 값보다 높을 가능성이 있습니다. 국소 DHA 농도는 세포가 활성화된 호중구 및 단핵구와 같은 반응성 산화제 종을 생성할 때 더 높을 수 있습니다. 또한, 아스코르베이트를 약리학적으로 투여할 경우 DHA 농도가 비례적으로 상승할 수 있습니다. 6 번째 탄소 위치 에 할로겐 치환이 있는 비타민 C 유사체는 미래에 비타민 C 수송 메커니즘, 특히 세포의 전체 아스코르베이트 함량에 대한 DHA 흡수의 기여를 분석하는 데 유용할 수 있습니다. 할로겐 유사체는 SVCT에 의해 운반되지만 산화되면 GLUT에 의해 운반되지 않습니다. 하이드록실기를 할로겐으로 대체하면 산화된 할로겐 DHA 종이 포도당과 유사한 이환식 헤미케탈과 같은 3차원 구성을 형성하는 것을 방지합니다( Corpe et al., 2005 )(그림 2).
GLUT에 의한 DHA 수송으로 인해 아스코르베이트 경제에서 DHA 수송의 역할을 특성화하는 것과 당뇨병에서처럼 고혈당증이 있는 DHA 수송의 조절 장애 가능성에 대한 관심이 남아 있습니다. 거의 40년 전, 일반적인 가설은 DHA를 통해 비타민 C가 당뇨병과 연관되어 있다는 것이었습니다( Mann & Newton, 1975 ). 불행하게도 최근까지 당뇨병 병태생리학을 DHA 수송 또는 비정상적인 DHA 수송과 연관시키는 구체적인 설명이 부족했습니다( Will & Byers, 1996 )( Chen et al., 2006 ). 쥐와 인간 적혈구에서 얻은 유망한 새로운 데이터는 DHA가 이들 세포로 수송되는 유일한 종이며, 고혈당증이 시험관 내 및 생체 내 수송을 억제한다는 것을 나타냅니다 ( Tu et al., 2015 ). 당뇨병 환자의 적혈구는 비타민 C가 낮고 구조 단백질 베타-스펙트린이 감소하여 더 단단했습니다. 따라서 당뇨병에서 비타민 C 농도가 낮은 적혈구는 당뇨병 혈관 질환의 특징인 미세혈관 저산소증에 기여하거나 심지어 유발할 수 있습니다( Tu et al., 2015 , 2015년 5월 ). 포도당 수송체는 쥐와 인간의 적혈구에서 다르기 때문에 향후 연구에서는 당뇨병이 없는 인간과 당뇨병이 있는 인간을 대상으로 한 임상 연구가 필수적일 것입니다.
요약하자면, SVCT 1과 2는 비타민 C를 세포로 운반합니다. 또한, 어떤 상황에서는 비타민 C가 세포로 축적되는 것이 다른 메커니즘(아스코르베이트 재활용 또는 DHA의 직접 수송)에 의해 발생할 수도 있습니다. 위에서 지적한 바와 같이, 아스코르베이트 재활용은 세포외 아스코르베이트가 데하이드로아스코르브산으로 산화되어 촉진적 포도당 수송체에 의해 운반된 후 세포내 환원에 의해 아스코르베이트로 효과적으로 포획되는 것을 의미합니다.
SVCT를 통해서든 아스코르베이트 재활용을 통해서든 수송이 어떻게 이루어지는지에 관계없이, 일부 세포로 수송된 비타민 C는 장과 신장에서처럼 세포 밖으로 나가야 합니다. 또한 다른 조직에서도 비타민 C가 분비됩니다. 여기에는 비타민을 합성할 수 있는 동물의 비타민 C 합성 부위인 간; 부신; 생식 기관들; 그리고 배. 출구 또는 유출의 메커니즘은 알려져 있지 않습니다. 비타민 C는 생리학적 pH에서 음이온이기 때문에 단순히 세포막을 통과하여 세포외액으로 확산될 수 없습니다. 비타민의 유출 수송체는 확인되지 않았습니다( Eck et al., 2013 ). 장 상피 및 근위 신장 세뇨관 세포의 경우 비타민 C는 SVCT1과 같은 관강 수송체에 의해 흡수됩니다. 일단 장 상피와 신세뇨관 세포 내부로 들어가면, 비타민은 아마도 기저외측 표면의 유출 수송체에 의해 빠져나와 혈장이나 세포외액으로 들어가야 합니다. 비타민C는 위액, 뇌척수액, 방수 등으로 분비되는데, 이들 모두 혈장보다 농도가 높습니다.그림 3). 비타민 C는 ACTH에 반응하여 인간의 부신에서도 분비됩니다. 인간의 부신에서 비타민 C 분비는 몇 분 안에 빠릅니다. 분비된 양은 부신 정맥에서 국소 혈장 비타민 C 농도를 몇 배 증가시키기에 충분하지만(섹션 참조: 인간 부신은 ACTH에 반응하여 비타민 C를 분비함), 전신 농도를 증가시키기에는 불충분합니다( Padayatty et al., 2007 ). 동물 데이터는 고환과 난소가 호르몬 신호에 반응하여 비타민 C를 분비할 수도 있음을 나타냅니다( Koba et al., 1971 )( Musicki et al., 1996 ). 호르몬에 의존하여 비타민 C가 빠르게 분비되는 데에는 수송 메커니즘이 관여할 가능성이 높지만 아직까지 밝혀지지 않았습니다. SVCT1과 2의 수송 동역학 특성은 비타민을 세포 내로 수송하는 데 이상적이지만 세포에서 혈장이나 세포외 체액으로 분비하는 데는 이상적이지 않습니다( Eck et al., 2013 ).
수송체 SVCT1은 신장의 근위 세뇨관에서 비타민 C 재흡수를 담당합니다. SVCT1 녹아웃 마우스는 소변에서 비타민 C를 재흡수할 수 없으며 주산기 사망률이 높습니다. 높은 주산기 사망률은 산모에게 비타민 C를 보충함으로써 거의 완전히 역전될 수 있습니다( Corpe et al., 2010 ). 이러한 녹아웃 마우스에서는 성체 마우스에 명백한 해를 끼치지 않는 낮은 비타민 C 농도가 분만 전후의 태아에게 해롭습니다. 자간전증 병력이 있는 환자를 대상으로 비타민 C가 고위험 임신의 결과를 개선할 수 있는지 여부를 테스트하기 위한 임상 연구가 수행되었습니다. 효과는 일관되지 않았는데, 그 이유는 비타민 C 섭취가 아래에 논의된 바와 같이 대조군에서도 조직 포화를 생성하기에 충분했기 때문입니다. 여성은 비타민 C 농도가 낮거나 높은 것에 따라 등록되지 않았는데, 부분적으로는 측정이 수행되지 않았기 때문입니다. 비타민 C가 비타민 농도가 낮은 환자의 임신 결과를 개선할 수 있는지 여부는 아직 알려지지 않았습니다( Rumbold et al., 2015 , Rossi & Mullin, 2011 ).
여러 단일 뉴클레오티드 다형성(SNP)이 SVCT에 설명되어 있습니다. SNP는 유전자의 단백질 코딩(엑손 SNP) 영역이나 인트론(인트론 SNP), 프로모터 또는 유전자간 영역을 포함한 다른 영역에 있을 수 있습니다. 일부 엑손 SNP는 단백질 생성물의 아미노산 서열을 변경할 수 있습니다(비동의 SNP, 미스센스 SNP). 다른 엑손 SNP의 경우, 뉴클레오티드 서열의 변화로 인해 단백질의 아미노산 서열이 변경되지 않습니다(동의어 SNP). 비동의적 SNP는 SVCT 단백질 기능을 변화시킬 가능성이 더 높으며, 이는 변경된 비타민 C 생리학에 반영될 수 있습니다. 그러나 단백질 생성물의 아미노산 서열을 바꾸지 않는 SNP(인트론 SNP, 동의어 SNP)라도 생체 내에서 기능적 변화를 일으킬 수 있는데 , 그 이유는 DNA 서열의 차이가 프로모터 활성이나 메신저 RNA 안정성에 영향을 미치는 등 많은 영향을 미칠 수 있기 때문입니다. 샤스트리, 2009 ) .
비타민 C 신장 재흡수를 감소시킴으로써 낮은 비타민 C 농도를 재현할 수 있는 여러 SNP가 인간 SVCT1 유전자에서 발견되었습니다( Corpe et al., 2010 )( Timpson et al., 2010 ). 관련 다형성은 세계의 다른 지역( Timpson et al., 2010 )보다 사하라 이남 아프리카( Eck et al., 2004 )( Erichsen et al., 2006 )의 인구에서 더 흔하며 단순히 다음을 반영할 수 있습니다. 아프리카에서 더 큰 유전적 다양성이 발견되었습니다( Jorde et al., 2000 , Witherspoon et al., 2007 , Tishkoff & Williams, 2002 , Tishkoff & Verrelli, 2003 , Reed & Tishkoff, 2006 ). 대안으로, 비타민 C가 풍부한 식품을 상대적으로 쉽게 구할 수 있기 때문에 SVCT1에 의한 비타민 C 수송 장애로 인한 위험이 감소하고 이러한 SNP가 이 집단에서 지속되도록 할 수 있습니다. 아직 알려지지 않은 다른 선택 압력도 이러한 SNP를 설명할 수 있습니다. 또 다른 가능성은 이러한 SNP가 비아프리카 인구에서는 더 드물다는 것입니다. 왜냐하면 이러한 인구는 아프리카에서 이주할 때 특히 비타민 C 함유 식품이 부족할 수 있기 때문입니다. 비타민C 섭취가 낮은 경우에는 비타민C를 보존하는 것이 필요하며, 비타민C 손실을 초래하는 SNP는 빠르게 선별될 것입니다.
비타민 C 수송에 대한 효과가 시험관 내에서 연구된 일반적인 SVCT1 SNP 외에도 (아래 참조)( Corpe et al., 2010 ), 흔하지 않거나 희귀한 SVCT1 SNP가 많이 확인되었습니다. 연구에서 DNA 시퀀싱의 사용이 증가함에 따라 이러한 SNP가 공개적으로 이용 가능한 데이터베이스에서 식별된 수백 개로 많아졌다는 것이 분명해졌습니다( ENSEMBL, 2015a , NCBI, 2015a ). 서로 다른 SVCT1 SNP가 너무 많기 때문에(각 개별 SNP는 흔하지 않지만) 일반적이지 않거나 희귀한 SVCT1 SNP는 잘 연구된 일반적인 SVCT1 SNP가 설명하는 것보다 일반 인구에서 SVCT1 SNP의 더 큰 비율을 누적적으로 설명할 수 있습니다. 이러한 흔하지 않은 SNP의 인구 분포는 알려져 있지 않으며 아프리카 인구에 기술된 SVCT1 SNP의 우세는 불완전한 지식 또는 확인 편향을 반영할 수 있습니다( Michels et al., 2013 ).
비타민 C 수송에 대한 SVCT1 엑손 SNP의 효과는 Xenopus laevis 난 모세포 발현 시스템을 사용하여 시험관 내에서 연구되었습니다 . 인간에서 흔히 발견되는 SNP를 포함하는 일반적인 유형의 SVCT1 또는 SVCT1이 난모세포에서 발현될 때, SNP를 포함하는 SVCT1 수송체를 발현하는 난모세포는 주변 배지로부터 비타민 C를 축적하는 능력이 감소된 것으로 밝혀졌습니다( Corpe et al., 2010 ). 이러한 체외 비타민 C 수송 연구에서 얻은 데이터는 정상 피험자의 데이터를 기반으로 한 수학적 모델을 사용하여 인간의 혈장 비타민 C 농도를 추정하는 데 사용되었습니다( Graumlich et al., 1997 , Padayatty et al., 2004 ). 계산 결과, SVCT1 SNP는 하루 30~2500mg 범위의 섭취량에서 정상 상태 공복 비타민 C 농도를 크게 감소시키는 것으로 나타났습니다( Corpe et al., 2010 ). 인구 연구에서는 특정 SVCT1 SNP가 있는 피험자의 혈장 비타민 C 농도가 감소한 것으로 나타났습니다. 그러나 이러한 감소는 위에서 설명한 약동학 모델링에 의해 예측된 것보다 적었습니다( Michels et al., 2013 )( Timpson et al., 2010 )( Cahill & El -소헤미, 2009 ). 비타민 C 섭취량이 낮은 사람들의 경우, SVCT1과 SVCT2의 이러한 다형성은 수정체와 방수의 낮은 비타민 C 농도와 관련이 있었습니다( Senthilkumari et al., 2014 ). 2개의 SVCT2 SNP(하나는 인트론이고 다른 하나는 엑손)와 대장 선종 사이에 부정적인 연관성이 나타났지만, 대장 선종은 일반적인 SVCT1 SNP와 연관되지 않았습니다( Erichsen et al., 2008 ). 또 다른 연구에서는 동의어인 SVCT1 SNP가 크론병의 위험을 증가시키는 것으로 나타났습니다( Amir Shaghaghi et al., 2014 ). 이러한 연관성 연구에서는 혈장, 조직 또는 소변에 대해 보고된 비타민 C 측정이 없었습니다. 따라서 이러한 발견을 비타민 C 생리학의 변화로 간주하는 것은 불가능합니다( Michels et al., 2013 ). 총 18,000명 이상의 환자를 대상으로 한 5개 연구에 대한 메타분석에서는 SVCT1 SNP와 심혈관 질환 위험에 기여하는 대사 매개변수 사이에 아무런 관계도 발견되지 않았습니다( Wade et al., 2015 ). 현재 인트론 및 엑손 SVCT 다형성의 임상적, 생리학적 중요성은 알려져 있지 않습니다. 비타민 C 생리학에 대한 유전적 다형성의 역할은 다른 곳에서 검토되었습니다( Michels et al., 2013 , Shaghaghi et al., 2016 ).
SVCT2는 몸 전체에서 발견되며 비타민 C를 조직으로 운반합니다. 위에서 언급한 바와 같이, SVCT2 녹아웃 마우스는 출생 직후 사망합니다. 태아 기관은 이형접합체 및 야생형 마우스에 비해 비타민 C 농도가 검출되지 않거나 매우 낮습니다( Sotiriou et al., 2002 ). 생쥐와 같은 비타민 C 합성 종의 경우 발달 중인 배아는 태아 발달 초기에 비타민 C를 합성하지 않습니다. 산모에서 태아로 비타민 C의 태반 수송은 태아 생존에 필수적이며, 이러한 수송은 태반의 SVCT2에 의해 매개됩니다. 태반의 비타민 C 수송은 산모 쪽보다 태반의 태아 쪽에서 더 높은 비타민 C 농도를 유지합니다. 따라서 비타민 C 농도는 모체 혈액보다 제대혈에서 더 높습니다.
SVCT2 녹아웃 마우스가 생존하지 못한다는 것은 포도당 운반체에 의한 DHA 흡수를 통한 비타민 C 획득이 생리학적으로 지배적이지 않으며 조직 수준에서 치명적인 괴혈병을 예방하는 데 적합하지 않다는 생체 내 증거 중 가장 유용합니다 . 그러나 SVCT2 녹아웃 마우스의 모든 조직에서 아스코르베이트가 측정되지 않았기 때문에 DHA 경로가 생체 내에서 하나 이상의 조직 또는 세포 유형에서 활용될 가능성이 여전히 있었습니다 . 따라서 DHA는 마우스와 인간의 적혈구에서 활용되는 독점적인 경로입니다( Tu et al., 2015 ). 당시에는 RBC 분석이 불가능했기 때문에 SVCT2 녹아웃 마우스에서는 적혈구 아스코르베이트가 측정되지 않았습니다( Li et al., 2012 ).
SVCT2 유전자는 SVCT1 유전자보다 더 많은 SNP(2000개 이상)를 보유하지만 이들은 내부 또는 동의어 SNP입니다(몇 가지 비동의 SNP가 최근 공공 데이터베이스에서 확인되었습니다)( ENSEMBL, 2015b , NCBI, 2015b ). SVCT2는 비타민 C를 다양한 세포로 운반하는 데 중요한 중요성을 반영하여 아미노산 서열의 변화에 덜 관대할 수 있습니다( Michels et al., 2013 )(SVCT2 녹아웃 마우스에서 출생 시 치사율로 나타남)( Sotiriou et al., 2002 ).
비타민 C의 흡수 및 조직 분포
비타민 C는 인간의 소장에서 흡수되어 섭취 후 약 120~180분 후에 최고 혈장 비타민 C 농도에 도달합니다. SVCT 1이 후보 전송기로 여겨지지만 다른 SVCT가 존재할 수도 있습니다. 대안적으로, 일부 아스코르베이트는 장에서 산화되어 GLUT2에 의해 DHA로 운반된 후 즉시 환원될 수 있습니다( Corpe et al., 2013 ). 주목할 점은 GLUT에 의한 DHA의 장내 수송과 이후 장세포 또는 장간막 시스템에서 아스코르베이트로의 감소는 SVCT1이 없는 마우스에서 아스코르브산 유사체가 흡수된다는 실험적 발견을 설명하지 못한다는 것입니다. 탈수소 형태로 산화되면 이 유사체는 이환식 헤미케탈 구조를 형성할 수 없습니다(그림 2), 유사체가 SVCT 녹아웃 마우스에 흡수되더라도 GLUT에 의해 운반되지 않습니다.
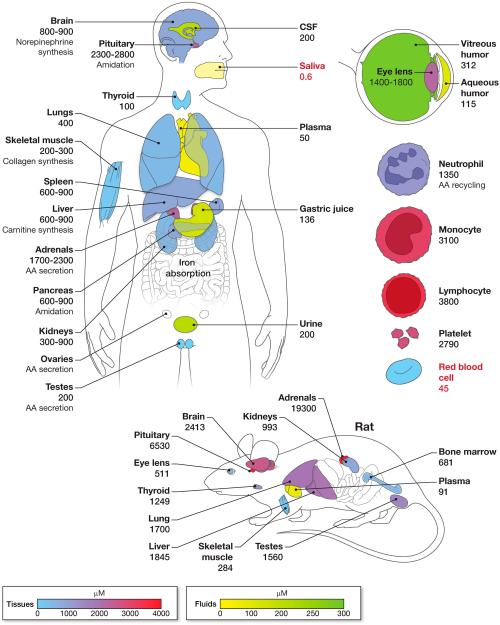
흡수된 후 비타민 C는 수용성이므로 혈액을 통해 세포외 공간으로 분산됩니다. 조직은 비타민 C(그림 3) 위에서 논의한 바와 같이 SVCT2를 통해 농도 구배에 대한 가능성이 높습니다. 조직 농도는 혈장 및 세포외액 비타민 C 농도에 따라 달라지며, 이는 다시 비타민 C의 식이 섭취량에 따라 달라집니다. 비타민 C의 조직 농도는 흔히 밀리몰입니다(그림 3)은 조효소로서의 작용에 필요한 양을 훨씬 초과합니다. 밀리몰 농도의 세포 내 비타민 C는 단순히 비타민의 저장소 역할을 할 수도 있고, 알려지지 않은 다른 기능을 가질 수도 있습니다.
많은 인간 조직의 경우 건강 상태와 질병 상태의 정확한 비타민 C 농도 측정이 알려져 있지 않다는 점에 유의해야 합니다. 인간의 비타민 C의 주요 부분은 간, 뇌 및 골격근에 있습니다. 골격근의 비타민C 농도는 다른 세포 유형에 비해 높지 않지만(그림 3), 골격근은 체중의 31~38%를 구성합니다( Janssen et al., 2000 ). 골격근 비타민 C 농도는 비타민의 식이 섭취와 균형을 이루는 것으로 보입니다( Carr et al., 2013 ). 인간의 조직 비타민 C 추정치(그림 3)은 사후 샘플과 부정확한 AA 에세이를 사용하여 여러 소스에서 수집된 데이터를 기반으로 합니다. 인체 체액이나 조직이 신속하고 적절하게 처리되지 않으면 산화 및/또는 검체 취급 관행으로 인해 비타민 C가 손실될 수 있으며 분석 결과가 인위적으로 낮을 수 있습니다. 다양한 비타민 C 섭취로 인한 체내 비타민 C 저장량을 계산하려면 이론적으로 조직/세포 농도를 혈장 농도와 일치시키는 것이 가능합니다. 불행하게도 단핵구, 림프구, 호중구, 혼합 단핵 세포, 골격근 및 적혈구에 대해서는 제한된 일치 값만 사용할 수 있습니다( Levine et al., 1996b )( Levine et al., 2001b )( Tu et al., 2015 , Carr et al., 2013 ). 이러한 데이터는 복용량과 관련된 비타민 C의 총 체내 저장량을 계산하기에는 충분하지 않습니다. 현대 HPLC 분석법을 사용하기 전에는 인체에 투여된 방사성 표지 아스코르베이트를 사용하여 체내 저장량을 추정했습니다( Baker et al., 1969 , Kallner et al., 1979 , Baker et al., 1971 ). 이러한 데이터의 한계는 방사성 표지가 인간에게 아스코르베이트로 남아 있다고 가정했지만 가정을 확인하기 위한 질량 측정이 수행되지 않았다는 것입니다.
동물 비타민 C 농도의 경우 설치류 데이터가 가장 풍부합니다. 보고된 쥐의 조직 비타민 C 농도는 인간의 비타민 C 농도보다 훨씬 높습니다.그림 3). 이는 설치류의 통제된 조건에서 신선한 조직을 쉽게 얻을 수 있어 비타민 C의 산화 및 비가역적 분해를 피할 수 있기 때문일 수 있습니다. 쥐의 혈장 비타민 C는 90μM인 것으로 보고되었습니다.그림 3), 현대 분석법을 이용한 최근 연구에서는 쥐( Corpe et al., 2013 )와 생쥐( Corpe et al., 2010 )에서 혈장 농도가 40 – 70 µM인 것으로 나타났습니다. 설치류에 대한 이전 보고서에 설명된 더 높은 혈장 농도는 부정확한 분광광도계/비색 분석으로 인한 것일 수 있습니다. 이러한 분석법은 혈장 샘플의 경우처럼 측정된 농도가 분석 범위의 하한값에 있을 때 비타민 C의 양을 과대평가할 수 있습니다. 보고된 수치가 더 높다는 것은 급성 스트레스로 인해 혈장 비타민 C 농도가 실제로 증가했음을 나타낼 수도 있습니다. 간섭 물질로 인해 분광광도계/비색 분석법은 마이크로몰 범위와 같이 비타민 C 농도가 낮을 때 부정확한 경향이 있습니다. 분광광도계/비색 분석법은 많은 조직의 경우처럼 아스코르베이트 농도가 특히 mM 범위에서 높을 때 간섭 물질(아마 고정된 양으로 존재하기 때문에)에 의해 덜 영향을 받습니다. 또한 혈장과 조직의 비타민 C 농도에 종의 차이가 있을 수 있으며, 특히 비타민 C를 합성하는 종(쥐, 생쥐)과 합성하지 않는 종(영장류) 사이에 차이가 있을 수도 있습니다. 많은 인간 조직에 대한 신뢰할 수 있는 비타민 C 농도(즉, 적절하게 획득 및 처리된 조직 샘플에서 추출되고 HPLC 분석으로 측정)는 아직 이용 가능하지 않습니다(특히 동시에 측정된 혈장 비타민 농도와 관련하여). 순환 세포 및 골격에 대해 위에서 언급한 예외를 제외하면 근육.
적혈구는 타액 이외의 유일한 신체 구획입니다.그림 3) 혈장의 농도와 비슷하거나 낮은 비타민C 농도를 가지고 있습니다( Li et al., 2012 )( Evans et al., 1982 )( Jacob et al., 1987 ). 최근까지 적혈구 비타민 C는 일반적으로 분광광도계/비색계 분석법을 사용하여 측정되었습니다( Butler & Cushman, 1940 , Barkhan & Howard, 1958 , Kassan & Roe, 1940 )}( Evans et al., 1982 )( Jacob et al., 1987 ). 비타민 C 농도가 과대평가되거나 불확실해지는 인공물( Li et al., 2012 , Mendiratta et al., 1998 , Iheanacho et al., 1995 , Okamura, 1980 , Westerman et al., 2000 , Lubschez, 1945 ) Iggo 등, 1956 , Washko 등, 1992 , Rumsey 등, 2000b ). 적혈구에서 비타민 C를 측정하는 HPLC 기술의 출현으로 이제 질병, 특히 당뇨병에서 비타민 C의 병태생리학을 배울 수 있는 가능성이 있습니다( Tu et al., 2015 ).
다른 조직과 달리 적혈구는 탈수소아스코르브산 경로를 통해 비타민 C를 얻습니다. 전구 적혈구 세포에는 SVCT2 수송체가 있지만 성숙 과정에서 이러한 수송체가 소실되어 순환하는 적혈구에는 알려진 비타민 C 수송체가 없습니다. 순환하는 적혈구는 혈장보다 비타민 C 농도가 약간 낮습니다. 적혈구는 혈장에서 발견되는 미량 농도의 DHA를 포도당 수송체로 수송한 후 즉각적인 세포내 환원을 통해 아스코르베이트를 얻습니다. RBC는 글루타레독신 단백질을 통해 또는 밀리몰 세포내 RBC 농도의 글루타티온으로부터 직접적인 화학적 환원을 통해 DHA를 감소시킬 수 있습니다. 적혈구로부터의 아스코르베이트 유출이 상대적으로 느리기 때문에 이 가설이 고려되었지만( Montel-Hagen et al., 2008 ), 적혈구는 적혈구로부터의 직접적인 유출을 기반으로 하는 혈장 비타민 C의 단순한 저장고가 될 가능성이 없습니다( May et al. , 1996 , Mendiratta 등, 1998 , May 등, 2001 ). 적혈구는 다른 혈액 세포보다 수가 많기 때문에 전혈 순환 세포에서 비타민 C의 대부분을 차지합니다( Barkhan & Howard, 1958 , Li et al., 2012 ).
적혈구에서 아스코르베이트의 기능은 불확실합니다. 최근까지( Li et al., 2012 ) 적혈구에서 아스코르베이트를 정확하게 측정할 수 없기 때문에 기능을 다루기가 어려웠습니다. 적혈구로부터의 아스코르베이트 유출의 가정된 역할 외에도, 다른 증거는 적혈구를 통한 아스코르베이트 기반 막횡단 전자 전달 기능을 뒷받침합니다. 가설은 아스코르베이트가 RBC 내부에서 외부 수용체로의 막횡단 전자 전달을 위한 전자 공여체이며, 아마도 플라즈마의 아스코르베이트 산화로 인해 형성된 아스코르베이트 라디칼일 가능성이 높다는 것입니다. 따라서 적혈구 내 아스코르브산염의 전자는 혈장 아스코르브산염을 유지하는 데 도움이 되지만 적혈구에서 아스코르브산염 자체가 직접 빠져나가지는 않습니다( May et al., 2000 )( May et al., 2004 ). 가설은 혈액 및 혈장 샘플의 비타민 C 안정성에 대한 관찰과 일치합니다( Dhariwal et al., 1991b )( Levine et al., 1999b )( Kassan & Roe, 1940 ). 인간 전혈에서 준비하여 24시간 동안 보관한 혈장 샘플의 비타민 C는 적혈구에서 분리하여 동일한 시간 동안 보관한 인간 혈장 또는 혈청 샘플의 비타민 C보다 더 안정적입니다( Dhariwal et al. , 1991b ). 비타민 C는 또한 적혈구 구조 단백질인 β-스펙트린을 유지하는 데 별도의 역할을 할 수도 있습니다. 비타민 C를 만들 수 없고 비타민 C 농도가 낮은 쥐에서는 적혈구의 β-스펙트린이 감소합니다. ß-Spectrin은 결핍된 쥐에게 다시 보충한 후 며칠 내에 정상 수준으로 돌아옵니다( Tu et al., 2015 ). 다른 적혈구 구조 단백질은 비타민 C 농도의 변화에 영향을 받지 않습니다. β-스펙트린의 유지에 아스코르브산염이 필요한 이유는 알려져 있지 않습니다. 콜라겐과 HIF-1α에서 프롤린의 아스코르베이트 의존성 수산화와 유사하게 아스코르베이트 의존적 방식으로 수산화되는 β-스펙트린(즉, 아르기닌, 아스파라긴)에 특정 아미노산이 있을 가능성이 있습니다.
비타민 C 생리학
인간의 비타민 C 생리학에 대한 현재의 지식은 건강한 젊은 피험자의 비타민 C 용량 농도 관계, 생체 이용률 및 신장 배설에 크게 제한되어 있습니다( Levine et al., 1996b , Levine et al., 2001b ). 많은 조사에서 정상인과 일부 질병 상태에서 비타민 C의 고갈율, 흡수, 혈장 및 세포 농도, 배설이 문서화되었습니다. ( Vinson & Bose, 1988 ) ( Mangels 등 , 1993 , Gregory, 1993 ) ( Blanchard, 1991b , Blanchard 등 , 1989 , Blanchard, 1991a , Baker 등 , 1971 , Hodges 등 , 1969 ). 결과는 다양했습니다. 아마도 불확실한 식이 조절, 부정확한 비타민 C 분석 또는 정상 상태에서 수행되지 않은 약동학 때문일 것입니다( Piotrovskij et al., 1993 ).
혈장 비타민 C 농도는 식이 섭취량에 따라 달라집니다. 위장관에 의한 비타민 C 흡수; 체액 내 분포 및 조직 흡수; 비타민 C의 비가역적 대사(이용); 그리고 신장에 의한 비타민 C 배설. 이러한 모든 요인은 질병에 따라 변경될 수 있으며 신체 구성, 유전학 및 신체 활동과 같은 기타 요인에 따라 달라질 수도 있습니다. 그러나 지금까지 확인된 혈장 비타민C 농도를 결정하는 가장 중요한 변수는 식이 섭취량입니다.
많은 연구에서 비타민 C의 식이 섭취와 혈장 및 순환 세포 내 비타민 C 농도 사이의 관계를 자세히 설명했습니다. 부유한 국가에서도 비타민의 낮은 식이 섭취량과 혈장 비타민 농도는 흔한 현상입니다. 2003~2004년 미국 내 시설에 수용되지 않은 민간인 7,277명을 대상으로 한 조사( Schleicher et al., 2009 )에서 6세 이상의 피험자의 평균 혈장 비타민 C 농도는 남성의 경우 48μM, 여성의 경우 54.8μM이었습니다. 그러나 남성의 8.2%와 여성의 6%는 혈장 비타민 C 농도가 괴혈병이 발생할 수 있는 농도인 11.4μM 미만이었습니다. 남성의 경우 흡연자의 18%, 비흡연자의 5.3%만이 이러한 낮은 수치를 나타냈습니다. 여성의 경우 흡연자의 15.3%, 비흡연자의 4.2%가 비슷하게 낮은 수치를 보였습니다. 이러한 값은 상당 부분 식사 섭취와 흡연에 따라 달라지지만 일부 질병 상태에서는 비타민의 산화적 분해나 신장 손실 증가로 손실이 증가할 수 있습니다.
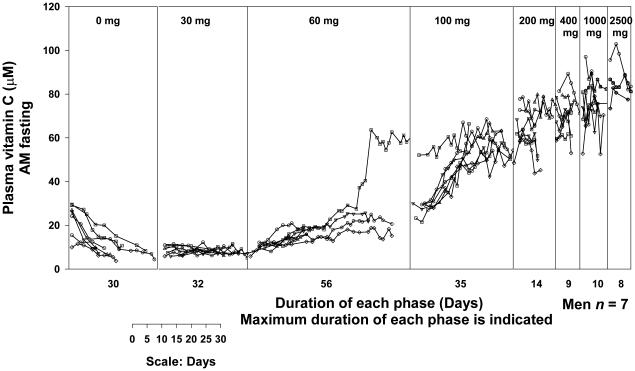
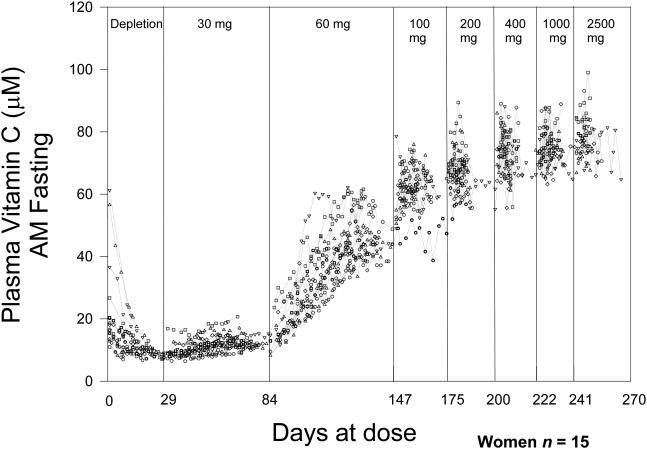
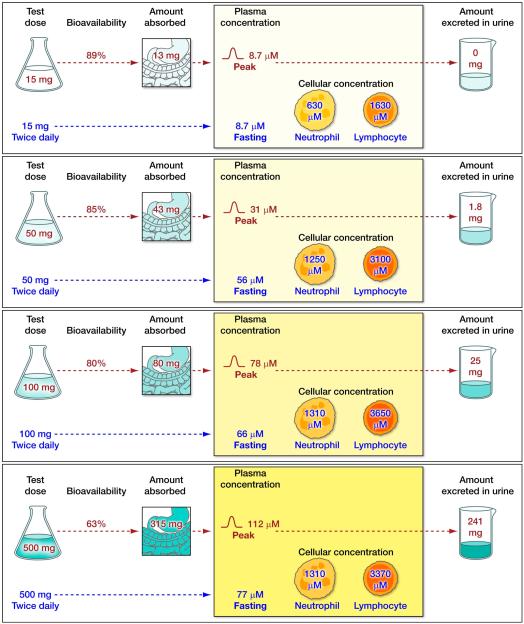
비타민 C 경구 투여량의 절대 생체 이용률은 신중하게 통제된 조건 하에서 수행된 고갈-충진 연구에서와 같이 피험자가 특정 투여량에 대해 항정 상태에 있을 때 결정될 수 있습니다( Young, 1996 , Graumlich et al., 1997 )( Levine et al. al., 2001b )(그림 4A 및 4B). 절대 생체 이용률은 정맥 투여량과 비교할 때 경구 투여량의 몇 퍼센트가 흡수되는지를 나타냅니다. 예를 들어, 30mg 경구 투여량의 생체 이용률은 대상체가 비타민의 혈장 및 조직 농도가 균형을 이룰 수 있을 만큼 충분히 오랫동안 이 용량(1일 2회 15mg 복용, 총 30mg/일)을 섭취했을 때 결정될 수 있습니다. 복용량. 이 평형 상태를 정상 상태라고 합니다. 정상 상태에서 30mg 경구 및 정맥 투여 후 혈장 비타민 C 농도를 사용하여 30mg 용량의 절대 생체 이용률을 계산할 수 있습니다. 정맥 투여 시 장을 우회하므로 정맥 투여 용량의 생체이용률은 완전 또는 100%로 간주됩니다. 조직이 혈장과 평형을 이루면 투여된 용량이 갑자기 조직에 흡수되지 않으므로 계산이 유효합니다. 반대로, 피험자가 어떤 용량에 대해서도 평형 상태에 있지 않으면 흡수 및 생체 이용률 계산이 신뢰할 수 없을 수 있습니다. 예를 들어, 30mg/일 용량의 평형 상태에 있는 피험자에게 훨씬 더 많은 용량(예: 200mg)을 투여하면 조직이 갑자기 더 높은 비타민 C 농도에 노출되고 혈장 농도가 예측할 수 없게 변할 수 있으므로 생체 이용률 계산은 다음과 같습니다. 신뢰할 수 없거나 가치가 의심스럽습니다. 절대 생체이용률에 대한 현재 데이터는 피험자가 각 특정 용량에 대해 항정 상태에 있을 때 15~1250mg의 용량과 관련이 있습니다( Graumlich et al., 1997 ).
흡수를 이해하는 데 유용하지만 정상 상태 조건은 실제 생활과 거의 관련이 없습니다. 환자가 경구 비타민 C 30mg 또는 1000mg을 복용하는 경우, 환자가 만성적으로 동일한 용량을 섭취하고 해당 용량에 대해 항정 상태에 있지 않는 한(음식에서 다른 비타민 C 섭취가 없다고 가정할 때) 현재 데이터는 용량에 대한 생체 이용률을 정확하게 예측할 수 없습니다. . 혈장 비타민 C 농도가 낮은 피험자에게 소량(예: 30mg/일)을 투여하면 생체 이용률이 매우 높습니다(100%에 가깝다는 의미). 세심하게 통제된 고갈-충만 연구에서 순수 비타민 C는 공복 상태에서 경구로 용액으로 투여되었습니다. 실제 생활에서 식품 내 비타민 C는 식품 내 비타민의 물리적 격리로 인해 또는 비타민 C가 분해되거나 다른 식품 성분에 의해 흡수가 억제되기 때문에 완전히 생물학적 이용이 가능하지 않을 수 있습니다. 음식에 함유된 일부 물질이 비타민 C 흡수를 향상시킬 수도 있습니다. 따라서 발표된 생체 이용률 데이터를 실제 임상 실습에 적용할 때는 신중하게 해석해야 합니다. 비타민 용량 농도 관계, 생체 이용률, 흡수량 및 소변으로 배설량을 요약하면 다음과 같습니다. 그림 5.
질병 상태의 비타민 C
결핍 상태 괴혈병 외에도 혈장 및 조직 비타민 C는 많은 질병 상태에서 변경될 수 있습니다. 비타민 C는 체내에서 가장 강력한 농도 의존적 수용성 항산화제이며( Frei et al., 1989 ), 체외 혈장에서 수용성 퍼옥실 라디칼과 지질/산화 생성물을 억제하는 주요 항산화제입니다 ( Frei et al., 1990 ). 이 과정에서 아스코르베이트가 비가역적으로 산화되면 비타민 C가 소비되고 비타민에 대한 식이 요구량이 증가합니다. 시험관 내에서 아스코르베이트는 다른 항산화제(요산, 토코페롤, 빌리루빈)보다 먼저 혈장에서 우선적으로 산화됩니다. 비타민 C와 기타 항산화제의 항산화 효과가 in vitro에서 입증되었지만 , 그러한 효과가 in vivo에서 입증되지 않는 한 연구 결과의 중요성은 불분명합니다 . 병리학적 과정을 항산화제 결핍이나 특정 항산화제의 부족으로 명확하게 분류하는 것은 불가능합니다.
많은 일반적인 임상 상태는 흡연과 당뇨병으로 인한 병리를 포함하여 병리학에 기여하는 산화촉진 상태를 초래하는 것으로 생각됩니다. 흡연자( Schectman et al., 1991 , Lykkesfeldt et al., 2000 , Smith & Hodges, 1987 , Kallner et al., 1981 , Schectman et al., 1989 ) 및 당뇨병 환자( Dorchy, 1999 , Seghieri et al., 1994) , Yue 등, 1990 , Som 등, 1981 , Stankova 등, 1984 , Will 등, 1999 , Sinclair 등, 1994 , Sargeant 등, 2000 ) ( Chen 등 2006 ; Tu et al 2015 )( Kaviarasan et al., 2005 )은 대조군보다 혈장 비타민 C 농도가 더 낮습니다. 이러한 발견은 낮은 식이 섭취 및/또는 비타민 C의 대사 증가로 인한 것일 수 있습니다. 시험관 내 및 생체 내에서 고혈당증은 적혈구 비타민 C 농도를 감소시킵니다( Tu et al., 2015 ). 생체 내에서 혈장 비타민 C 농도의 감소가 직접적인 포도당 독성으로 인한 것인지, 아니면 간접적으로 당뇨병의 다른 대사 결과로 인한 것인지는 확실하지 않습니다. 비타민 C 농도는 심근경색( Hume et al., 1972 , Riemersma et al., 2000 ), 급성 췌장염( Bonham et al., 1999 , Scott et al., 1993 ), 패혈증 (Hume et al., 1972, Riemersma et al., 2000)을 포함한 급성 질환에서도 낮을 수 있습니다. Fowler et al., 2014 ) 및 심각한 질병이 있는 환자( Berger & Oudemans-van Straaten, 2015 ). 낮은 혈장 및 조직 비타민 C 농도가 병리학에 기여하거나 질병 과정의 결과일 가능성이 있습니다. 반면에 낮은 농도는 단순히 질병 상태와 연관될 수 있지만 원인은 아닙니다. 이러한 질병 상태에서는 순환하는 산화제가 혈장에 존재할 수 있습니다. 이러한 산화제는 생체 내에서 비타민 C에 아무런 영향을 미치지 않지만 환자에게서 비타민 C를 제거하고 분석을 기다리고 있는 경우 여전히 혈액 내 비타민 C를 산화시킬 수 있습니다. 비타민 C 분석을 방해하는 다른 물질도 존재할 수 있으므로 측정 인공물의 가능성을 고려해야 합니다( Padayatty & Levine, 2000 ). 질병 상태는 최적이 아닌 영양 상태와 연관되어 있으며 낮은 비타민 C 농도는 단순히 섭취 부족을 반영할 수 있습니다( Dallongeville et al., 1998 ). 항산화제로서 비타민 C의 역할은 다른 곳에서 자세히 검토되었습니다( Padayatty et al., 2003).). 비타민 C는 신장으로 배설되기 때문에 신부전 시 축적될 수 있으며, 혈액투석 중 투석액으로 소실되기도 한다( Sullivan & Eisenstein, 1970 , Balcke et al., 1984 , Handelman, 2011 , Clase et al., 2013 ) . 신부전 환자의 비타민 C 대체는 비타민 C 결핍과 비타민 C 독성을 모두 피하기 위해 이러한 요소를 모두 고려해야 합니다( Pru et al., 1985 , Balcke et al., 1984 , Ono, 1986 ).
구강 건강과 관련된 비타민 C
비타민 C 측정은 다양한 구강 조직에서 수행되었지만 임상적 해석은 종종 문제가 됩니다. 괴혈병에 걸리기 쉬운 동물의 모델로 기니피그를 사용한 비타민 C에 대한 초기 연구에서는 치아가 투여된 비타민 C의 상당량을 흡수한다는 것을 보여주었습니다( Burns et al., 1951 ). C13으로 표지된 비타민 C는 아스코르베이트가 풍부한 기니피그( Hornig et al., 1974 )와 아스코르베이트가 고갈된 기니피그( Hornig et al., 1972 ) 에서 이하선과 턱밑샘에 축적됩니다 . 치주 조직과 치아 치수에서 일부 흡수가 관찰되었습니다( Hornig et al., 1972 )( Hornig et al., 1974 ). 쥐 이하선의 선포 세포에 있는 분비 과립은 밀리몰 농도의 비타민 C를 함유하고 있으며 아밀라제와 함께 분비됩니다( Vonzastrow et al., 1984 ). 정상 쥐와 비교하여 뇌하수체 절제술을 받은 쥐에서는 아직 알려지지 않은 메커니즘에 의해 타액선을 포함한 많은 조직에서 비타민 C 축적이 감소합니다( Horning et al., 1972 ). 비타민C는 타액선에서 분비되며 타액에 낮은 농도로 존재합니다. 인간의 타액 비타민 C 농도에 대한 연구는 감지할 수 없는 것( Feller et al., 1975 )부터 매우 낮은 농도 또는 혈장 농도에 가깝거나 높은 것( Anonymous, 1986 , Diab-Ladki et al., 2003 , Schock )까지 매우 다양한 결과를 보여주었습니다. 등, 2004년 , Liskmann 등, 2007년 , Rai 등, 2011년 , Rai 등, 2007년 , Buduneli 등, 2006년 , Gumus 등, 2009년 , Feller 등, 1975년 , Makila & Kirveskari, 1969 , Moore 등, 1994 , Bates 등, 1972 , Vaananen 등, 1994 , Leggott 등, 1986b , Leggott 등, 1986a , Makila, 1968 , de Sousa 등, 2015 , Saral et al., 2005 ). 균형적으로 볼 때, 타액의 비타민 C 농도는 혈장의 농도보다 낮은 것 같습니다. 타액 비타민 C 농도는 비타민 C 섭취 시 몇 시간 내에 증가합니다( Makila & Kirveskari, 1969 ). 비타민 C 농도는 턱밑, 설측 및 이하선 침샘 사이에서 다양하지 않지만( Makila & Kirveskari, 1969 ), 턱밑에서 타액 흐름이 증가하면 감소하지만 이하선에서는 그렇지 않습니다( Makila & Kirveskari, 1969 )). 후속 연구에서 예상대로 혈장 아스코르브산 농도는 비타민 C 고갈 및 보충과 동시에 발생했지만 타액 아스코르브산 농도는 변하지 않았는데, 이는 아마도 분석의 검출 하한선에 있었기 때문일 것입니다( Leggott et al., 1986b ). 타액 내 비타민 C 농도에 대한 이러한 광범위하게 불일치하는 보고는 간섭 물질의 영향을 받은 분석에 기인하거나( Feller et al., 1975 ) 샘플 수집 및 처리의 차이 때문일 수 있습니다. 표준화된 방법론, 세심한 시료 처리 및 구체적이고 정확한 현대적인 분석 방법으로 이 문제를 해결할 수 있습니다. 타액 내 비타민 C의 기능은 아직 알려져 있지 않습니다.
괴혈병의 경우 구강 징후와 증상이 두드러지며, 출혈과 해면질 치은이 나타나 결국 치아가 흔들리고 손실됩니다. 괴혈병의 근본적인 병리학적인 원인은 교체나 박테리아 활동으로 인해 손실된 콜라겐이나 치아 조직을 대체하는 능력이 손상된 것일 수 있습니다. 지속적으로 치아가 자라는 기니피그에서는 비타민 C가 제거되면 치아 성장이 멈춥니다( Dalldorf & Zall, 1930 ). 남성의 괴혈병에 대한 미국의 연구에서 괴혈병의 징후는 비타민 C 중단 후 약 40일 후에 나타나기 시작했습니다( Hodges et al., 1969 , Hodges et al., 1971 , Hood et al., 1970 ). 구강 병변은 치은 부종, 치은 출혈, 설하 점상 출혈로 구성되었습니다. 병변은 치은 가장자리를 따라 시작되어 치간유두까지 확장되었으나 X-ray상 치주막은 손상되지 않았습니다. 치은염이 있는 환자에게서 병변이 더 두드러졌습니다. 건강한 치은을 가진 피험자에서는 경미한 치은 병변만이 있었고 무치악 피험자에서는 전혀 없었습니다. 일부 대상자들은 또한 구강 건조증과 이하선 및 턱밑 침샘의 비대를 포함하는 쇼그렌 증후군을 가졌습니다( Hodges et al., 1969 , Hodges et al., 1971 , Hood et al., 1970 ). 이 연구에서 괴혈병의 징후와 증상은 나중에 발생했으며 역사적 기록에 보고된 것보다 덜 심각했습니다. 아마도 선원이나 다른 집단의 괴혈병이 훨씬 더 불리한 조건에서 발생했기 때문일 것입니다. 육상 괴혈병이나 해상 괴혈병에 걸린 사람들은 복합적인 영양 결핍과 감염으로 고통받았을 가능성이 가장 높았으며 대개 힘든 육체 노동에 참여했습니다. 의사 조사관의 자가 유발 실험 괴혈병에서 괴혈병의 징후는 자가 보고된 비타민 C가 없는 식단을 섭취한 지 161일 후에만 나타났습니다( Crandon et al., 1940 ). 피험자는 구강 위생이 양호했고 비타민 C 외에 영양 결핍은 없었습니다. 괴혈병의 확실한 징후일 수 있는 X-레이에서 보이는 층판의 중단을 제외하고는 치아나 치은에 큰 변화가 보이지 않았습니다. 잇몸 생검은 정상이었습니다. 이러한 연구에서 괴혈병의 치은 병변은 치아가 있고 기존 치은염 및/또는 치아 우식증이 있는 사람에게서만 발생한다는 것이 분명합니다. 건강한 남성을 대상으로 한 비타민 C 고갈-충진(및 두 번째 고갈) 연구에서 낮은 혈장 비타민 C는 치주 질환과 관련이 없었지만 치은 염증 및 출혈과 관련이 있었습니다( Leggott et al., 1986a ).
괴혈병이 없는 경우 정상적인 치아 건강을 유지하는 데 있어서 비타민 C의 역할은 불분명합니다. 치아와 치은의 정상적인 건강을 위해서는 적절한 조직, 혈장 및 타액 비타민 C 농도가 필수적일 수 있습니다. 낮은 혈장 비타민 C는 빈곤과 관련이 있으며 열악한 치아 건강을 혈장 비타민 C를 포함한 어느 한 요인의 탓으로 돌리는 것은 어렵습니다( Vaananen et al., 1994 ). 비타민 C의 낮은 세포 농도가 구강 건조의 원인이거나( Enwonwu, 1992 ), 비타민 C가 프로스타글란딘 생성을 증가시켜 타액 생성을 증가시킨다( Horrobin & Campbell, 1980 )는 가설이 세워졌습니다. 통제되지 않은 연구에서, 비타민 C를 포함한 물질의 혼합물로 쇼그렌 증후군(비타민 C 결핍으로 인한 것이 아님)을 치료하면 증상이 호전되는 것으로 보고되었지만( Horrobin et al., 1981 ), 다른 연구에서는 호전이 발견되지 않았습니다( McKendry, 1982). ). 최근 SVCT1의 희귀 SNP와 공격성 치주염 사이의 연관성이 발견되었습니다( de Jong et al., 2014 ). 그러한 유전학 연구로부터 결론을 도출하기에는 너무 이르지만, 가능성이 있는 분야입니다.
국소적으로 작용하는 비타민 C는 치아에 침식 효과를 줄 수 있습니다. 비타민 C 섭취로 인한 치아 부식에 대한 보고가 있지만( Giunta, 1983 , Imfeld, 1996 ), 이는 비타민의 광범위한 사용을 고려하면 흔하지 않습니다. 시험관 내에서 아스코르브산에 장기간 노출되면 주사 전자 현미경으로 볼 수 있는 치아 침식( Giunta, 1983 )이 발생합니다( Meurman & Murtomaa, 1986 ). 츄어블 비타민 정제(또는 실험적으로 사용된 비타민 C 500mg 웨이퍼)는 2분 30초 만에 타액 pH를 7에서 약 4.5로 감소시켰습니다( Hays et al., 1992 ). 건강한 피험자의 경우 기계적인 세척 없이도 비타민 C를 섭취한 지 1주일 후에도 치아에 아무런 변화가 나타나지 않았습니다( Meurman & Murtomaa, 1986 ). 그러나 씹을 수 있는 비타민C( Giunta, 1983 )나 발포성 비타민C( Meurman & Murtomaa, 1986 )를 만성적으로 섭취하면 치아 법랑질이 침식될 수 있습니다. 비타민 C 시럽을 함유한 자당도 치아에 산성 손상을 일으킬 수 있다는 것이 제안되었습니다( Woods, 1981 ).
비타민 C에 관한 실험 결과
인간이나 인간 세포에 비타민 C를 포함하는 수많은 실험 현상이 있지만 그 결과가 정상적인 생리학, 병태생리학, 임상 사용 또는 질병 치료와 어떻게 관련되는지에 대해서는 불확실성이 있습니다. 아래에 설명된 세 가지 결과와 각각에 대해 임상적으로 관련된 질문이 있습니다.
활성화된 인간 호중구는 비타민 C를 축적합니다.
병원성 박테리아에 노출되면 인간의 호중구가 활성화되어 병원체를 죽이는 산화제를 생성합니다. 이러한 산화제는 호중구 자체와 다른 조직에 부수적인 손상을 일으킬 수 있습니다. 새로 얻은 정상 인간 호중구가 E. coli, Enterococcus faecalis, Moraxella catarrhlis, Klebsiella oxytoca, Acinetobacter baumanii 또는 C. albicans 의 임상 분리주에 노출 되면 호중구는 활성화되어 외부에서 이용 가능한 모든 배지가 나올 때까지 주변 배양 배지로부터 빠르게 비타민 C를 축적합니다. 비타민 C는 고갈됩니다( Wang et al., 1997 )( Washko et al., 1993 ). 호중구 내부의 비타민 C 농도는 약 1mM의 시작 농도에서 10~12mM만큼 높은 값으로 증가합니다( Wang et al., 1997 )(그림 6). 가능한 메커니즘은 아스코르베이트 재활용을 통한 것입니다( Stankova et al., 1975 )( Bigley & Stankova, 1974 )( Hemila et al., 1984 )( Anderson & Lukey, 1987 ). 위에서 설명한 바와 같이 이는 호중구의 산화제가 외부 아스코르브산염의 산화를 촉진하여 포도당 운반체를 통해 운반되는 데히드로아스코르브산으로 바뀌고 내부적으로 즉시 아스코르브산염으로 환원된다는 것을 의미합니다. 활성화된 호중구에서 비타민 C 농도가 그토록 빠르고 빠르게 증가하는 이유는 무엇입니까? 한 가지 가능성은 비타민 C가 호중구가 생성하는 산화제로부터 호중구를 보호하는 데 사용된다는 것입니다. 반대로, 비타민 C는 산화제 생성을 증가시켜 병원균을 확실히 죽일 수 있습니다. 이러한 질문에 대한 답변은 임상적 관련성을 가질 수 있습니다. 그렇다면 건강한 환자의 호중구 작용을 향상시키는 데 아스코르베이트가 임상적으로 중요한가요? 호중구에서 아스코르브산염이 증가하는 기전은 포도당 수송체와 관련이 있으므로, 당뇨병 환자의 호중구 작용에 추가 비타민 C가 유용할 수 있습니까? 호중구에 작용하는 추가 비타민 C가 패혈증의 결과를 개선할 수 있습니까? ( Fowler et al., 2014 ) ( Voigt et al., 2002 ) ( Fowler et al., 2014 , Ferron-Celma et al., 2009 ) 아스코르베이트를 추가하면 만성 육아종성 질환 환자의 박테리아 사멸이 개선됩니까? 이 질병을 앓고 있는 환자들은 건강한 사람에게는 흔하지 않은 재발성 세균 감염을 갖고 있으며, 감염은 치료하기 어렵고, 이 질병을 앓고 있는 환자의 호중구는 세균이 있을 때 아스코르베이트 농도를 증가시키지 않습니다( Curnutte, 1993 , Thrasher et al., 1994). , Roos 등, 1996 , Holland, 2010 , Wang 등, 1997 ).
적혈구와 비타민C
위에서 논의한 바와 같이, 순환하는 적혈구는 DHA를 운반하고 이를 세포 내에서 AA로 감소시킵니다. 혈장 아스코르브산은 적혈구 내 아스코르브산에 의해 유지된다는 증거가 있습니다. 임상 시료에서 혈장 내 비타민 C는 시료 처리 시점까지 혈장이 적혈구에서 분리되지 않을 때 훨씬 더 오래 유지됩니다( Dhariwal et al., 1991b ). 적혈구가 제거된 혈장은 손실을 방지하기 위해 특별한 예방 조치를 취하지 않는 한 비타민 C를 매우 빠르게 손실합니다. 적혈구가 혈장 비타민 C를 안정화시키는 방법은 전자 전달 단백질에 의해 적혈구 막을 통해 적혈구 내 아스코르브산으로부터 전자가 전달되기 때문일 수 있습니다( Su et al., 2006 )( May et al., 2000 )( VanDuijn et al., 2000 ). 이러한 적혈구 단백질은 인간과 같이 비타민 C를 만들 수 없는 종에서 발견되지만, 설치류와 같이 비타민 C를 합성하는 종에는 없습니다. 적혈구를 통한 전자 전달은 질병이나 당뇨병과 같이 혈장 비타민 C가 감소하는 상태에서 중요할 수 있습니다. 실제로 위에서 논의한 최근의 흥미로운 발전에도 불구하고( Tu et al., 2015 ) 적혈구에서 비타민 C 자체의 기능은 알려져 있지 않습니다. 비타민 C가 적혈구에서 중요한 기능을 갖고 있다면 이것이 기능적 결과 또는 수혈을 위한 혈액 저장 기능으로 수혈된 적혈구와 관련이 있습니까?
인간 부신은 ACTH에 반응하여 비타민 C를 분비합니다.
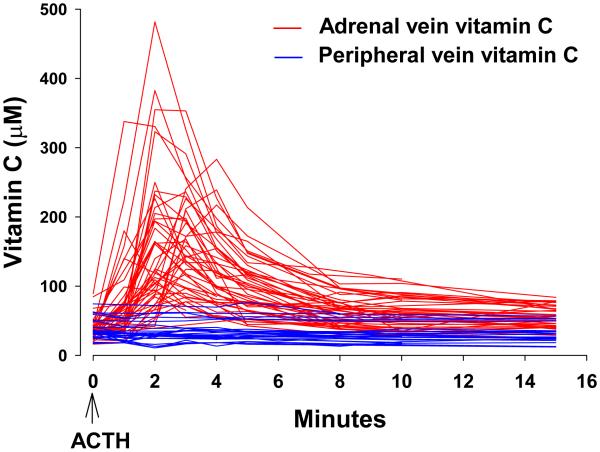
부신은 비타민 C 농도가 매우 높은 것으로 알려져 있으며 Albert Szent-Györgyi는 처음으로 이를 황소 부신에서 분리했습니다. 생체 내 인간 부신은 부신 피질을 자극하여 필수 호르몬인 코티솔을 생성하는 ACTH에 반응하여 비타민 C를 분비합니다. 비타민 C 분비는 인간에게 ACTH 투여 후 몇 분 안에 시작되고 끝나게 됩니다.그림 7), 코티솔 분비보다 먼저 발생합니다( Padayatty et al., 2007 ). 부신에서 비타민 C가 방출되는 기능은 무엇입니까? 프로스타글란딘이나 호르몬 자극에 반응하여 비타민 C 분비가 동물의 고환과 난소에서도 나타났습니다( Koba et al., 1971 )( Petroff et al., 1998 )( Guarnaccia et al., 2000 ). 비타민 C 방출은 이러한 스테로이드 분비선에서 유사한 기능을 가지고 있습니까? 인간의 경우 부신 정맥의 비타민 C 농도는 혈장 농도의 약 5배에 이릅니다. 부신 정맥에서 일시적으로 발견되는 값에 근접하는 최대 혈장 비타민 C 농도는 매우 많은 양(1~3g/일)의 비타민 C 보충제를 섭취하는 사람들의 일반 순환계에서 달성될 수 있습니다( Padayatty et al., 2004 ). 그러한 농도로 인해 부신 기능이 모방되거나 방해됩니까?
비타민C 권장 섭취량
미국과 캐나다의 비타민 C 권장 섭취량(RDA)은 여성의 경우 75mg, 남성의 경우 90mg입니다( 식품영양위원회, 2000b ). 지난 15년 동안 많은 국가에서 비타민 C의 RDA가 미국 및 캐나다와 유사하거나 약간 더 높아질 정도로 증가했습니다.
비타민 C의 초기 RDA는 괴혈병을 예방하는 데 필요한 비타민 C의 양에 안전 한계를 보장하고 개인차를 고려하여 추가된 양을 기준으로 했습니다. 영국( Peters et al., 1953 ), 캐나다( Johnstone et al., 1946 ) 및 미국( Hodges et al., 1969 , Baker et al., 1969 , Baker et al., 1971 , Hodges et al.) 에서 수행된 인간 실험 ., 1971 )은 하루 10mg 이하의 비타민 C가 괴혈병을 예방하는데 충분하다고 결론지었습니다. 이러한 연구는 수십 년 동안 비타민 C RDA의 기초를 형성했습니다. 그러나 이러한 연구에는 불완전한 식이 조절, 다양한 영양 결핍 가능성, 부정확한 비타민 C 분석 사용 등 많은 결함이 있었습니다. 그럼에도 불구하고, 알려진 양의 비타민 C 섭취가 관찰 가능한 임상 결과에 미치는 영향이 나타났습니다.
이상적인 RDA는 단순히 결핍 상태(이 경우 괴혈병)를 예방하는 것이 아니라 최적의 건강을 유도하는 섭취를 기반으로 해야 합니다. 목표는 칭찬할 만하지만, 지금까지는 도달하기가 쉽지 않았습니다. 이는 우리가 어떤 비타민에 대해서도 최적의 건강 상태를 측정하는 방법을 잘 모르기 때문입니다. 따라서 어떤 비타민C 섭취가 건강에 가장 적합한지를 나타내는 데이터가 없다는 것은 예측 가능합니다.
미국 국립과학원(National Academy of Sciences) 의학연구소의 식품영양위원회는 2000년에 이전에 사용된 비타민 C 신체 저장량이나 임상적 결핍 기준과 다른 지침을 사용하여 비타민 C에 대한 RDA를 개정했습니다. 비타민 C의 경우, 이 지침에는 항산화 보호 기능을 제공하는 비타민 C의 능력이 포함되어 있습니다. 인간 호중구의 시험관 내 발견은 건강한 젊은 남성의 비타민 C 용량 농도 관계에 대해 발표된 임상 데이터와 결합되어 섭취량을 추정했습니다( Food and Nutrition Board, 2000b ). 비타민 C 섭취량을 임상 결과에만 관련시킨 이전 권장 사항과 달리, 임상적으로 관련된 비타민 C 농도가 어떻게 과산화물 생성을 억제하는지 설명하는 시험관 내 데이터가 활용되었습니다. 불행하게도 우리는 새로운 기준이 온전한 인간의 건강에 적용되는지 아니면 생체 내 생리학 과 관련이 있는지 알지 못합니다 .
현재 RDA는 어떻게 계산되었나요? 최소한의 소변 손실과 일치하는 위에 자세히 설명된 호중구 비타민 C 데이터를 사용하여 비타민에 대한 추정 평균 요구량(EAR)을 계산했습니다. 비타민 C에 대한 EAR은 해당 연령 및 성별 그룹의 건강한 인구의 50%의 영양 요구 사항을 충족하는 것으로 추정되는 일일 평균 비타민 C 섭취량입니다. 그런 다음 EAR의 표준 편차를 고려하여 EAR을 사용하여 RDA를 계산했습니다. 비타민 C의 경우 요구사항의 표준편차에 대한 데이터가 없기 때문에 변동계수를 10%로 가정합니다. RDA는 특정 연령 및 성별 그룹의 건강한 개인의 97-98%의 영양 요구 사항을 충족하는 일일 평균 비타민 C 섭취량입니다( Hellwig et al., 2006 , Food and Nutrition Board, 2000b ). 예를 들어, 19-30세 남성의 경우 비타민 C의 EAR은 75mg/일이고, 이 연령 및 성별 그룹의 비타민 C RDA는 90mg/일입니다( Hellwig et al., 2006 , Food and Nutrition) 보드, 2000b ). 이러한 기준은 보충제가 아닌 식품을 통한 비타민 섭취를 기준으로 합니다.
부분적으로 시험관 내 데이터를 기반으로 권장 사항을 제시하고 이러한 데이터를 인간에게 추정하는 데는 한계가 있습니다( Harper, 1975 ). 그러나 주요 인간 데이터가 없기 때문에 식품영양위원회는 비타민 C에 대해 그러한 추정이 필요하다고 간주했습니다. 비타민 E 권장 사항에도 유사한 근거가 사용되었습니다( 식품 영양 위원회, 2000a ).
비타민 C의 RDA는 10mg/일 정도로 낮았지만 수년에 걸쳐 점차 증가하여 현재는 거의 100mg/일입니다. 하루 10mg의 비타민 C를 섭취하면 혈장 비타민 C 농도가 약 10μM이 되며, 하루 100mg의 비타민 C를 섭취하면 혈장 비타민 C 농도가 약 50μM이 됩니다. 이는 비타민 C가 섭취하는 혈장 농도에 가깝습니다. 소변으로 빠져나갑니다. 비타민 C가 소변으로 손실되면 보충제에서 일시적으로 발견되는 용량을 제외하고는 경구 투여 시 혈장 및 조직 수준이 더 이상 증가하지 않습니다. NIH 고갈 보충 연구에서는 혈장 농도가 약 20μM 미만일 때 피로가 발생했습니다( Levine et al., 1996b )( Padayatty & Levine, 2001a ). 일반 인구의 일부 사람들은 비타민 C 결핍의 다른 징후 없이 비타민 C 농도가 10μM에서 20μM 사이일 때 피로를 경험할 가능성이 있습니다. 이러한 낮은 농도는 새로운 더 높은 RDA로 피할 수 있으며, 이는 더 높은 RDA의 의도하지 않은 이점일 수 있습니다. 반대로, 피로는 임상 실습에서 흔한 증상이며, 비타민 C 결핍으로 인한 경우는 거의 없습니다. 현재 RDA는 괴혈병을 예방하는 입증된 임상적 이점이 있는 양보다 높지만, 현재 임상적으로 정량화할 수 없는 다른 이점이 있을 수 있습니다.
요약하자면, 최적의 건강을 위해 얼마나 많은 비타민 C 섭취가 이상적인지는 알려져 있지 않습니다. 비타민 C에 대한 요구량은 유전적으로 결정된 비타민 C 수송이나 대사, 질병 상태에 따라 달라질 수 있습니다( Yew, 1975 ). 예를 들어, 장기간 바다에 있었던 선원들에게 괴혈병이 만연하던 당시 모든 남성에게 괴혈병이 발병한 것은 아니었습니다. 탑승한 모든 남성(소수의 장교 제외)은 동일하거나 매우 유사한 식단을 섭취했으며, 많은 사람(절반 정도)이 치명적인 괴혈병에 걸렸지만 다른 사람은 영향을 받지 않거나 거의 영향을 받지 않았습니다. 따라서 괴혈병에 대한 감수성은 개인간 상당한 차이가 있었습니다. 비타민 C는 음식을 통해 쉽게 얻을 수 있으므로 임상 실습에서는 어떤 음식이 일반적인 건강상의 이점을 가지고 있는지 고려하는 것이 더 나을 것입니다.
그렇다면 우리는 비타민C를 얼마나 섭취해야 하며, 어떻게 섭취해야 할까요? 하루에 다양한 과일과 채소를 5회 섭취하면 충분한 양의 비타민 C(비타민 C 약 200~250mg)를 얻을 수 있습니다. 많은 관찰 연구와 제한적 개입 실험에서 과일 및 야채 섭취 증가가 심혈관 위험 및 모든 원인으로 인한 사망률을 줄이는 데 도움이 되는 것으로 나타났습니다( Wang et al., 2014 , Hartley et al., 2013 , Woodside et al., 2013 )( Hung et al., 2004 ). 과일 및 야채 섭취가 풍부한 식단은 높은 사회 경제적 지위(서구 국가의 경우), 교육 및 건강한 생활 방식을 포함한 많은 요소와 관련이 있습니다. 과일과 채소는 또한 고칼로리 식품을 대체하고, 부피와 섬유질, 미량 영양소와 식물화학물질을 제공합니다. 카로티노이드와 비타민 C를 포함한 많은 물질의 혈장 농도는 다양한 과일과 채소를 많이 섭취하는 사람들에게서 증가합니다. 그러나 연관성은 인과관계가 아니며, 과일과 채소의 유익한 효과의 메커니즘은 알려져 있지 않습니다. 이용 가능한 정보를 고려하여 가장 좋은 조언은 다양한 색상의 과일과 채소를 섭취하는 것입니다. 하루 5회 섭취하면 하루 200~250mg의 비타민 C를 제공하여 혈장과 조직이 거의 포화 상태가 됩니다.
생리학을 규명하기 위한 실험적 연구의 관련성: 골디락스를 기억하기
수많은 연구에서 비타민 C가 많은 생리학적 매개변수 또는 세포 기능에 미치는 영향을 보여주었지만, 이러한 발견이 임상 생리학 및 병태생리학과의 관련성은 여전히 불분명합니다. 이러한 많은 연구에서는 비생리학적 용량의 비타민 C를 사용하거나 너무 높거나 너무 낮은 생리학적 범위에서 멀리 떨어진 혈장 또는 조직 농도에 도달했습니다. 이러한 우려 중 일부는 다른 곳에서 검토되었으며( Levine et al., 2011 ) 우리는 이러한 연구에 대한 신중한 해석의 필요성에 대한 논의를 제한했습니다. 본질적으로 Goldilocks가 실험실 실험과 인간 실험 모두에서 완전히 이해할 수 있는 문제가 있습니다. 해석이 타당하려면 비타민 C 상태가 생리학을 반영하여 "딱 맞아"야 합니다. 비타민 C가 너무 적거나 너무 많으면 결과를 해석하기가 어렵습니다.
비타민 C를 이용한 시험관 연구 의 해석
대부분의 포유류 세포는 아스코르브산염을 함유하지 않고 스코르부틴성인 세포 배양 배지에서 잘 자랍니다. 대조적으로, 온전한 동물은 동물에 의해 합성되거나 음식에서 얻어지는 비타민 C가 없으면 생존할 수 없습니다. 시험관 내에서 사용되는 배양 세포는 아스코르베이트가 없을 때 생존하고 증식하도록 적응했거나 아스코르베이트 결핍으로 인해 치명적이지 않은 미묘한 이상을 가지고 있습니다. 두 경우 모두, 이들 세포는 세포가 항상 10μM ~ 70μM(비타민 C 보충제를 섭취하는 사람의 경우 더 높은 농도) 범위의 아스코르베이트 농도에 항상 노출되는 정상적인 인간 생리학을 대표하지 않을 수 있습니다. 또한, 비타민C는 순환계에 가장 풍부한 수용성 항산화제입니다. 아스코르베이트 없이 수행되는 항산화 메커니즘을 탐구하는 세포 배양 연구는 최소한 생체 내 생리학을 대표하지 못할 것입니다. 아스코르베이트 보충이 수행될 때 이상적으로 세포는 생리학적 농도의 아스코르베이트에 노출되어야 하지만 생리학적 범위를 벗어나는 매우 높거나(>100μM) 또는 매우 낮은(<10μM) 비타민 C 농도에 노출되어서는 안 됩니다. 세포 배양 조건에서 아스코르베이트는 불안정하며, 적절한 양을 반복적으로 보충해야만 아스코르베이트의 일정한 농도를 유지할 수 있습니다. 불행하게도 아스코르베이트 생리학을 세포 실험에 적용하는 방법에 대한 이해가 제한적인 경우가 많습니다. 결과적으로, 생리학적 아스코르베이트 농도가 짧은 기간 동안 세포에 첨가된 후 효과가 결정됩니다. 대부분의 경우 이 시간은 세포가 생리학적 세포내 농도를 달성하는 데 충분하지 않습니다. 따라서 결과의 의미가 의심스러워집니다.
스펙트럼의 다른 측면은 일부 시험관 내 실험에서 연구자들이 mM 범위에서 매우 높은 농도 또는 약리학적 농도의 아스코르베이트를 추가했다는 것입니다. mM 농도를 추가하면 아스코르베이트 라디칼과 과산화수소가 생성될 수 있습니다. 결국 이들 화합물은 아스코르베이트 생리학과 무관한 세포에 많은 작용을 합니다( Levine et al., 2011 ). 세포에 대한 이러한 작용은 질병 치료, 특히 암 치료에서 아스코르베이트 사용에 대한 새로운 통찰력을 제공할 수 있습니다. 그러나 약리학적 아스코르베이트 작용은 아스코르베이트 생리학과 관련이 없을 수도 있다는 점을 기억해야 합니다.
비타민 C를 이용한 생체 내 연구 의 해석
유사하게, mM 농도의 아스코르베이트의 생체 내 주입은 혈관 확장을 포함한 많은 효과를 입증하는 데 사용되었습니다( Levine et al., 1996a , Motoyama et al., 1997 , Beckman et al., 2001 , Vita et al., 1998 , Jackson et al. al., 1998 , Duffy et al., 2001 , Kaufmann et al., 2000 ). 결과는 반복 가능하더라도 비타민 C 생리학을 나타내는 것이 아니라 오히려 비타민 C의 약리학적 사용을 나타냅니다( Padayatty & Levine, 2001b ). 이러한 연구는 항산화 작용이나 개념 증명과 같은 특정 효과를 입증하는 데 유용합니다( Kaufmann et al., 2001 ). 주입된 비타민 C를 사용하는 다른 연구에서는 약리학적 특성이 연구되고 있다는 이해를 바탕으로 암 치료( Levine et al., 2011 )( Yun et al., 2015 )에서 연구하고 있습니다. 이러한 연구는 약물로서 아스코르브산의 새로운 용도를 이해하는 데 매우 유용할 수 있지만, 원하는 임상 효과를 달성하기 위한 비타민 C의 최적 식이 섭취량이나 아스코르베이트 경구 보충제를 결정하는 데는 유용하지 않습니다. 따라서 비타민 C를 이용한 시험관 내 및 생체 내 실험 결과는 이러한 모든 요인, 특히 비타민 C의 용량 농도 관계를 고려하여 해석되어야 합니다.
골디락스 및 중재 시험: 용량-농도 관계의 중요성
많은 소규모 및 대규모 중재 실험에서 비타민 C 보충(단독 또는 다른 영양소와 함께)이 임상 결과에 미치는 영향을 연구했습니다. 이는 효과가 없거나 매우 작은 효과를 나타냈습니다. 이러한 부정적인 결과는 비타민 C가 연구된 상태에 임상적 영향을 미치지 않았다는 것을 나타낼 수 있습니다. 또는 이러한 연구에는 혈장 및 조직 비타민 C 농도와 관련하여 실질적으로 다르지 않은 대조군 및 치료 그룹이 있었을 수 있으므로( Levine et al 1999a )( Padayatty & Levine, 2009 ) 비타민에 기인한 효과를 감지하는 것이 불가능했습니다. . 비타민C 용량 농도 관계는 선형이 아닌 S자형 관계이기 때문에 연구가 신중하게 설계되지 않으면 이러한 결과가 발생할 가능성이 높습니다. 비타민 C 고갈 상태에 있는 환자의 경우, 혈장 비타민 C 농도는 소량의 비타민 C(<30mg/일) 후에만 약간 증가하지만 약간 더 많은 용량(>100mg/일) 후에는 정체 상태에 도달하기 전에 훨씬 더 증가합니다. 예를 들어, NIH 고갈 보충 연구에 등록한 남성의 경우, 공복 상태의 정상 상태 혈장 비타민 C 농도는 일일 비타민 C 섭취량 30mg에 대해 8.7μM이었습니다. 100mg/일 섭취 시 혈장 값은 56μM으로 증가했고, 400mg/일 섭취 시 혈장 값은 70μM으로 증가했습니다. 여성에 대한 해당 값은 다음과 같습니다: 30mg/일 - 12.6μM; 100mg/일 - 62μM; 400mg/일 - 73μM. 따라서 비타민 C의 RDA(남성의 경우 90mg/일, 미국의 경우 여성의 경우 75mg/일)보다 훨씬 높은 섭취량은 혈장 비타민 C 농도의 작은 증가만을 가져왔습니다(참조:그림 4A 및 4B) ( Levine et al., 1996b , Levine et al., 2001b ). 이러한 발견은 몇 가지 중요한 의미를 갖는다. 첫째, 중재 연구가 영양이 풍부한 통제 및 중재 그룹(음식에서 하루 약 100mg의 비타민 C 섭취)으로 시작되면 비타민 C 보충은 혈장 및 조직 비타민 C 농도를 약간만 증가시킬 것입니다. ( Levine et al 1999a ) ( Padayatty & Levine, 2009 ). 이러한 사소한 변경에는 입증 가능한 이점이 없을 수 있으며 예상대로 그렇습니다. 둘째, 혈장 비타민 C 농도가 낮은 집단을 선택하여 보충제( Levine et al 1999a )( Padayatty & Levine, 2009 )가 혈장 및 조직 비타민과 관련하여 대조군과 치료군 사이에 명확한 차이를 생성할 수 있도록 하는 것이 필요합니다. C 농도( Padayatty & Levine, 2009 ). 따라서 이익(또는 해악)을 입증할 가능성이 크게 증가합니다( Lykkesfeldt & Poulsen, 2010 ). 이를 보장하려면 기준선에서, 이상적으로는 보충 후 혈장 비타민 C 농도를 측정해야 합니다( Padayatty & Levine, 2009 )( Padayatty & Levine, 2014 ). 비타민 C 보충으로 인한 효과를 감지하고 중재 연구가 유익함이나 해로움을 감지할 수 있는 합리적인 기회를 갖도록 하려면 용량 농도 관계에 대한 세심한 주의가 필수적입니다( Morris & Tangney, 2011 ). 마지막으로, 이러한 원칙은 비타민 C뿐만 아니라 다른 비타민에도 적용됩니다. 비타민의 증가가 결과를 변화시키는지 여부를 알아보는 것이 목표인 경우, 보충으로 인해 비타민 농도가 약간 이상 변화할 수 있는 연구 집단을 선택하는 것이 중요합니다. 이러한 농도는 해당 비타민을 투여하기 전과 후에 측정해야 하며 대조군에서도 측정해야 합니다.
S자형 용량 집중 반응의 중요성은 다음 예에 나와 있습니다. 자간증에 대한 항산화제의 효과에 대한 연구에서 자간전증의 위험이 높은 283명의 임산부에게 비타민 C 1000mg/일(비타민 E 포함) 또는 위약을 투여했습니다. 연구 집단에서는 약 30μM의 혈장 비타민 C 농도가 측정되었으며 이는 치료 그룹에서 ~ 50μM까지 증가했습니다( Chappell et al., 1999 ). PAI-1/PAI-2 비율(PAI-1/2: 자간전증의 지표인 Plasminogen Activator Inhibitor 1 또는 2)은 자간전증과 마찬가지로 보충군에서도 감소했습니다. 결과를 검증하기 위해 자간전증 및 주산기 합병증의 위험이 있는 1,877명의 임산부로 구성된 대규모 코호트를 대상으로 후속 연구가 수행되었습니다. 비타민 C 1000mg/일(비타민 E 추가)을 투여했지만 혈장 비타민 C 농도는 측정되지 않았습니다( Rumbold et al., 2006 ). 그러나 처리군에서의 보충에도 불구하고 계산된 혈장 비타민 C 농도는 대조군과 처리군 모두에서 대략 70~80μM이었습니다( Padayatty & Levine, 2006 ). 당연히 이 연구에서는 아무런 이점도 나타나지 않았습니다. 10,154명의 임산부를 대상으로 고혈압 예방을 위해 비타민 C 1000mg/일(비타민 E 추가)을 투여한 후속 연구에서 혈장 비타민 C는 측정되지 않았으며 보충은 아무런 이점도 보이지 않았습니다( Roberts et al., 2010 ). 연구 집단이 기준선에서 충분한 영양을 섭취했기 때문에 이 결과도 예측 가능했습니다. 이러한 연구와 유사한 연구에서는 중재 그룹이 이미 비타민 C를 충분히 섭취했을 가능성이 높고 비타민에 관해 대조군과 실질적으로 다르지 않았기 때문에 비타민 C의 실제 효과 부족과 명백한 효과 부족을 확실하게 구별할 수 없습니다. 보충제를 섭취하더라도( Rumbold et al., 2006 , Padayatty & Levine, 2006 , Sesso et al., 2008 , Padayatty & Levine, 2009 , Fortmann et al., 2013 , Padayatty & Levine, 2014 , Isanaka et al., 2012 , Padayatty & Levine, 2013 ). 비타민 C 보충 연구와 다른 영양소에 대한 연구에서 용량-농도 관계를 고려하는 것은 좋은 연구 설계에 매우 중요합니다( Levine et al 1999a )( Padayatty & Levine, 2009 )( Morris & Tangney, 2011 )( Lykkesfeldt & Poulsen , 2010 ).
완전히 알려지지 않은 일부
최근 연구에서 비타민 C 생리학의 여러 측면에 대한 새로운 사실이 밝혀졌지만 여전히 수수께끼는 남아 있습니다. 이러한 수수께끼 중 몇 가지가 아래에 나열되어 있습니다.
1) 대부분의 동물은 비타민C를 합성하지만 일부 동물은 그 능력을 상실했습니다. 비타민 C 합성 능력이 부족한 동물은 서로 어떤 계통발생적 관계도 맺지 않으며, 이는 많은 독립적인 돌연변이가 모두 동일한 표현형을 초래한다는 것을 의미합니다. 일반적인 환경 영향은 분명하지 않습니다. 현재까지 비타민 C 합성 능력의 명백한 무작위 손실에 대한 만족스러운 진화론적 설명은 없습니다. 다른 동물이 비타민 C 합성 능력을 상실한 것으로 인식되지 않았을 가능성은 여전히 남아 있습니다. 합성되지 않은 모든 동물을 식별하면 패턴 인식을 향상시킬 수 있지만 지금까지 어떤 것도 분명하지 않습니다.
2) 비타민 C는 인간과 많은 포유류의 대부분의 조직에 농축되어 있습니다. 그러나 알려진 비타민 C의 효소 작용에는 훨씬 더 낮은 농도, 때로는 1~2배 더 낮은 농도만 필요합니다. 왜 조직은 비타민 C를 그토록 열성적으로 획득합니까? 가능한 설명은 필요한 기능보다 훨씬 더 높은 농도를 유지하는 것이 진화적인 보호 또는 "안전" 기능일 수 있다는 것입니다. 이 경우 섭취가 갑자기 중단되면 효소 결과와 결핍이 발생하는 데 시간이 걸릴 것입니다. 대안적으로, 효소 작용에 필요한 것보다 훨씬 더 높은 농도의 세포내 축적은 비타민 C가 아직 알려지지 않은 다른 기능을 가지고 있음을 나타낼 수 있습니다.
3) 아스코르베이트를 정맥내 또는 비경구 투여하는 경우에만 세포외액에서 고농도(μM 대비 >5 mM)의 비타민 C가 생성됩니다. 약리학적 농도의 아스코르베이트는 과산화수소를 생성합니다(그림 8). 과산화수소 또는 산화제 종은 과산화물에 의해 암세포에 손상을 주지만 정상 세포에는 손상을 주지 않습니다. 혈액에서 이러한 산화제 종은 측정 역치보다 낮습니다. 이는 아마도 적혈구의 큰 환원 능력 때문일 것입니다. 자연적으로 아스코르베이트의 약리학적 농도는 혈액이나 세포외액에서 발생하지 않습니다. 그러나 그러한 농도는 많은 조직의 세포 내에서 발생합니다. 아스코르브산을 정맥내 또는 비경구적으로 투여하면 세포외액뿐만 아니라 세포 내에서도 mM 농도의 아스코르브산이 발생합니다. 정상 세포의 경우 아스코르베이트를 약물로 투여하여 유해한 산화제를 해독하는 중복된 세포내 메커니즘이 있습니다. 이러한 메커니즘은 생리학의 일부인 아스코르베이트의 정상적인 mM 세포내 농도로 인해 발생하는 산화제로부터 세포를 보호할 수도 있습니다. 두 가지 예 모두에서 아스코르베이트와 관련하여 가장 중요한 해독 경로는 무엇입니까, 아니면 의도적인 중복이 있습니까? 과산화수소에 민감한 다양한 유형의 암세포에서 어떤 경로가 결핍되어 있습니까? 아스코르베이트는 산화제를 생성하므로 세포 유형에 따라 주요 손상 경로가 세포 내부 또는 외부 또는 둘 다에서 시작됩니까? 세포내 손상은 전사(DNA) 수준, 번역(RNA) 수준 또는 번역 후(단백질, 소기관 또는 막) 수준에서 시작됩니까? ( Parrow 외, 2013 ).
세포에서 ROS를 해독하는 경로는 많이 알려져 있습니다. Ascorbate는 일부 분비 소포에 격리되어 있습니다. 그러나 조사할 때마다 아스코르베이트는 다른 세포 내 구획에 존재하지 않는 것으로 나타났습니다. 이러한 구획화는 일부 세포 유형에서 가능하지만 아직 발견되지 않았습니다.
4) 인간의 경우 아스코르베이트는 트로픽 호르몬인 ACTH에 반응하여 부신에서 빠르게 방출/분비됩니다. 동물의 경우 고환과 난소에서도 아스코르브산염이 분비됩니다. Ascorbate 분비는 위에서도 발생합니다. Ascorbate 릴리스는 어떤 기능을 제공합니까? 아스코르베이트 분비 메커니즘은 무엇입니까?
알려져 있지만 증거가 불완전함
아스코르베이트 생리학에 대한 우리의 이해에는 많은 불확실성이 있습니다. 이는 분자 작용에서부터 권장되는 식이 허용량까지 확장됩니다. 비타민C가 부족하면 필연적으로 괴혈병이 발생합니다. 괴혈병의 많은 징후와 증상은 알려진 아스코르베이트의 효소 작용과 일치합니다. 예를 들어 치아의 느슨해짐과 조직 파괴는 콜라겐을 교차 결합할 수 없음을 반영하여 결합 조직의 구조적 약화를 초래할 수 있습니다. 무기력함은 에피네프린 합성 장애, 펩타이드 호르몬의 아미드화 결함, 카르니틴 합성 장애(또는 세 가지 모두)를 반영할 수 있습니다. 그러나 특정 효소 결함을 괴혈병의 징후 및 증상과 결론적으로 연결하는 실험적 증거는 없습니다. 또한 이러한 많은 효소 작용에서 아스코르베이트의 역할은 생체 내에서 명확하게 입증되지 않았습니다 . 시험관 내에서 아스코르브산염이 필수 전자 공여체(다른 환원제와는 반대로)에 관한 특이성 데이터가 불완전합니다. 그럼에도 불구하고 괴혈병은 비타민 C를 투여하지 않고 치료할 수 없으므로 일부 생화학적 경로에는 비타민 C에 대한 특정 요구 사항이 있어야 합니다.
비타민 C는 화학적 성질상 일반적으로 항산화제라고 불리는 전자 공여체입니다. 그러나 비타민 C가 인간의 항산화제로서 중요한 역할을 한다는 널리 알려진 가정은 입증되지 않았습니다. 현재까지 비타민 C 보충은 산화 스트레스로 인해 발생하거나 결과적으로 발생하는 것으로 제안된 질병 상태에 아무런 이점이 없는 것으로 나타났습니다( Padayatty et al., 2003 ). 게다가, 위에서 자세히 설명한 비타민 C 농도와 관련하여 치료군과 대조군 사이의 부적절한 차이 문제로 인해 많은 보충제 시험이 어려움을 겪고 있습니다.
비타민 C에 대한 몇 가지 일반적인 질문
1. 비타민C가 감기 예방이나 치료에 효과가 있나요? Cochrane Reviews( Douglas et al., 2000 , Hemilä et al., 2007 )( Hemila & Chalker, 2013 )에서는 비타민 C가 감기 예방 또는 치료에 사용되었다는 발표된 연구에 대한 메타 분석을 실시했습니다. 경구용 비타민 C를 하루 200mg 이상의 용량으로 사용한 29개의 위약(반드시 무작위로 배정된 것은 아님) 대조 시험이 분석되었습니다. 일반 인구에서 예방적으로 복용한 비타민 C 보충제는 감기 발병에 아무런 영향을 미치지 않았지만, 감기 증상의 지속 기간(성인 8%, 어린이 13%)과 중증도를 줄이는 데는 어느 정도 효과가 있었습니다. 마라톤 선수와 같이 심한 운동을 한 사람들(5번의 실험)에서는 감기에 걸릴 위험이 절반으로 줄었습니다. 비타민 C를 이용한 감기 치료(7건의 임상시험)는 효과가 없었습니다. 요약하자면, 비타민 C는 아마도 대부분의 사람들에게 감기를 예방하지 못할 것입니다. 일부 사람들, 특히 격렬한 운동을 하는 사람들에게는 지속 시간에 경미하거나 중간 정도의 영향이 있을 수 있습니다. 저렴한 비용과 안전성, 그리고 적당한 이점이 있지만 일관성이 있기 때문에 비타민 C 보충에 금기 사항이 없는 감기 환자의 경우 비타민 C 보충을 개별적으로 고려할 수 있습니다( Hemila & Chalker, 2013 ).
2 - 보충제로 복용하는 그램 용량의 비타민 C 사용을 지지하거나 반대하는 증거가 있습니까? 비타민 C의 생체 이용률은 복용량에 따라 급격히 감소합니다. 비타민 C 1250mg을 건강한 젊은 남성에게 해당 용량에 대해 항정 상태로 경구 투여할 때 생체 이용률은 46%입니다. 흡수된 양은 거의 모두 24시간 이내에 소변으로 배설됩니다( Levine et al., 1996b , Graumlich et al., 1997 ). 권장 식사 허용량을 초과하는 비타민 C 섭취에 대한 임상적 이점은 나타나지 않았습니다. 현재 권장 사항은 부작용, 특히 팽만감과 삼투성 설사를 예방하기 위해 하루 2g을 초과하는 복용량을 피해야 한다는 것입니다. 이러한 복용량이 고옥살산뇨증을 유발하는지 여부는 불분명합니다( Food and Nutrition Board, 2000b , Handelman, 2007 , Auer et al., 1998 ). 보충적인 비타민 C는 포도당 6 인산 탈수소효소 결핍 환자( Mehta et al., 1990 )와 발작성 야간 혈색소뇨증 환자( Iwamoto et al., 1994b )( Iwamoto et al., 1994a )에서 용혈을 일으킬 수 있습니다. 비타민 C 섭취는 또한 신장 기능이 손상된 사람들에게 옥살산염 축적을 일으킬 수 있습니다( Canavese et al., 2005 ). 금기 사항이 없는 사람들에게는 비타민 C 보충이 안전한 것으로 보입니다( Levine et al., 1999a , Food and Nutrition Board, 2000b ). 비타민 보충제가 치아 부식과 같은 국소적인 영향을 미칠 수도 있습니다( Giunta, 1983 ). 기타 부작용은 드물게 발생할 수 있습니다. 식도 미란, 신장 장애( Nakamoto et al., 1998 , Nasr et al., 2006 , Rathi et al., 2007 , Mashour et al., 2000 ) 및 다른 약물이나 보충제와의 예상치 못한 상호 작용( Bromley )에 대한 사례 보고가 있었습니다. et al., 2005 ).
3 - 고용량 정맥 투여 비타민 C의 치료 용도는 무엇입니까? 정맥 투여된 비타민 C는 경구 섭취로는 불가능한 약리학적 농도를 생성합니다. 정맥 내로 최대 100g까지 투여되는 비타민 C는 감염, 암 및 기타 질환을 치료하는 데 수십 년 동안 사용되어 왔습니다( Padayatty et al., 2010 ). 이점을 테스트하기 위한 엄격한 시험은 아직 수행되지 않았습니다. 정맥내 아스코르베이트는 통합의학(보완의학 및 대체의학) 의사들에 의해 널리 사용됩니다. 정맥 내로 투여된 비타민 C( Padayatty et al., 2004 )는 어떠한 명백한 부작용 없이 유리한 안전성 프로파일을 가지고 있습니다( Hoffer et al., 2008 ) Padayatty et al., 2010). mM 혈장 농도 또는 약리학적 농도에서 비타민 C는 산화촉진제 역할을 합니다. 동물 연구에 따르면 이러한 약리학적 농도의 아스코르베이트만이 세포외액에서 아스코르베이트 라디칼과 과산화수소를 생성하는 것으로 나타났습니다.그림 8)( 첸 외, 2005 ). 약리학적 아스코르베이트 농도는 시험관 내 및 동물 연구에서 항종양 활성을 나타냅니다 ( Chen et al., 2008 , Chen et al., 2007 )( Parrow et al., 2013 , Yun et al., 2015 ). 소규모 1상 임상 연구에서 정맥 투여된 아스코르베이트는 안전했습니다. 전이성 췌장암 환자의 생존율은 두 배로 늘었지만 후향적 대조군만 사용했습니다. 암 환자에게 비타민 C 정맥 투여의 이점을 테스트하기 위한 2상 및 3상 연구는 아직 수행되지 않았습니다. 그러한 시험을 엄격하게 통제하고 투여량 크기와 빈도를 고려하는 것이 필요합니다. 이러한 시험은 항암제로서의 아스코르베이트 효능에 관한 질문을 다룰 것입니다( Parrow et al., 2013 ).
감사의 말
SJP 감사합니다 Drs. 유용한 제안을 해주신 Michael Espey, Peter Eck, Nermi Parrow; 데이터베이스에 기탁된 SVCT SNP에 대한 정보는 Dr. Eck에게 문의하세요. 그리고 NIH Medical Arts의 Ethan Tyler가 새롭고 수정된 삽화를 제공했습니다.
이 작업은 국립 보건원(National Institutes of Health) 당뇨병 및 소화기 및 신장 질환 연구소의 교내 연구 프로그램(프로젝트 번호: 1ZIADK053211-08)의 지원을 받았습니다.
약어 목록
| AA | 아스코르브 산 |
| ACTH | 부신피질자극호르몬 |
| CGD | 만성 육아종성 질환 |
| DHA | 데히드로아스코르브산 |
| 귀 | 예상 평균 요구 사항 |
| 그 안에 | HIF를 억제하는 요인 |
| 과다 | 포도당 수송체 |
| GRD | 글루타티온 환원효소 |
| GSH | 글루타티온 |
| GSSG | 글루타티온 이황화물 |
| HIF | 저산소증 유발 인자 |
| HPLC | 고성능 액체 크로마토 그래피 |
| 나드프 | 니코틴아미드 아데닌 디뉴클레오티드 인산염 |
| 농촌진흥청 | 권장 식단 허용량 |
| RNOS | 반응성 산화질소종 |
| 로스 | 활성산소 종 |
| SNP | 단일 뉴클레오티드 다형성 |
| SVCT | 나트륨 의존성 비타민 C 수송체 |
| 번호 | 분류 | 제목 | 조회 수 | 추천 수 | 날짜 |
|---|---|---|---|---|---|
| 공지 | 전문정보 |
pubmed 의학/약학 논문 전문사이트
|
1423 | 0 | 2024.04.01 |
| 공지 | 🚨(뉴비필독) 전체공지 & 포인트안내 22 | 29313 | 64 | 2024.11.04 | |
| 공지 | URL만 붙여넣으면 끝! 임베드 기능 | 23240 | 44 | 2025.01.21 | |
| 475 | 잡담 | 과자 고르듯이 약을... 창고형 약국 인기에 약사들 반발 3 | 1170 | 0 | 2025.06.19 |
| 474 | 잡담 |
국내 첫 '마트형 약국' 등장에…동네 약국들은 긴장
3 |
1195 | 0 | 2025.06.19 |
| 473 | 잡담 | 후두암의 초기 증상과 원인, 대처 방법 완벽 가이드 1 | 621 | 0 | 2025.05.09 |
| 472 | 잡담 | 외이도염 초기증상과 원인, 두통 대처법 총정리 | 593 | 0 | 2025.05.09 |
| 471 | 잡담 | 장꼬임(장폐색) 증상과 치료 방법 알아보기 1 | 611 | 0 | 2025.05.09 |
| 470 | 잡담 | 소화불량 증상과 소화에 좋은 음식 1 | 569 | 0 | 2025.05.09 |
| 469 | 잡담 | LDL 콜레스테롤을 낮추는 음식과 정상수치 가이드 | 624 | 0 | 2025.05.09 |
| 468 | 잡담 |
다들 제발제발제발 이 3개만 매일 해줘... 진짜 삶이 달라진다
|
577 | 0 | 2025.05.09 |
| 467 | 잡담 | 너무아파서 자다깼는데 근육통에 무슨약이 잘들어? 2 | 589 | 0 | 2025.03.19 |
| 466 | 잡담 |
약사가 실제로 먹고 효과 본 영양제 조합! 눈 피로, 근육통, 장 건강부터 암 예방까지
|
9970 | 0 | 2025.03.07 |
| 465 | 잡담 |
다이소 영양제 총정리: 가성비 좋은 제품 vs. 돈값 안 하는 제품
|
9906 | 0 | 2025.03.07 |
| 464 | 잡담 |
Vitamin B-Complex (Pure vs Thorne) 총평
1 |
10007 | 0 | 2025.03.05 |
| 463 | 잡담 | 장누수,피부트러블,두피염,무좀 다 말살시킴 1 | 9962 | 0 | 2025.03.05 |
| 462 | 잡담 | 영양제 26종 챙겨먹는 사람인데 | 9717 | 0 | 2025.03.05 |
| 461 | 잡담 |
레이 커즈와일 평소 사진.jpg
|
9774 | 0 | 2025.03.05 |
| 460 | 잡담 | 여드름쟁이들 보시길 | 9755 | 0 | 2025.03.05 |
| 459 | 잡담 |
항산화제의 두얼굴 그리고 근육키우기
|
9931 | 0 | 2025.03.05 |
| 458 | 정보📰 |
OptiMSM Flake 와 Powder 차이에 관한 제품 설명
|
9774 | 0 | 2025.03.05 |
| 457 | 잡담 |
오메가3 ALA -> EPA DHA 전환률
3 |
9816 | 0 | 2025.03.05 |
| 456 | 잡담 |
다이소 건기식 철수는 진짜 약사들의 집단 이기주의다
|
9768 | 0 | 2025.03.05 |
| 455 | 잡담 |
다이소 영양제 목록 (4)
|
9733 | 0 | 2025.03.05 |
| 454 | 잡담 |
다이소 영양제 목록 (3)
|
10020 | 0 | 2025.03.05 |
| 453 | 잡담 |
다이소 영양제 목록 (2)
|
9928 | 0 | 2025.03.05 |
| 452 | 정보📰 |
다이소 영양제 목록 (1)
|
9885 | 0 | 2025.03.05 |
| 451 | 잡담 |
대한약사회에서 입장문 발표햇엇네
1 |
9865 | 0 | 2025.03.05 |
| 450 | 잡담 |
요즘 핫하다는 다이소 영양제 찐 약사가 리뷰 했던데
1 |
9810 | 0 | 2025.03.05 |
| 449 | 잡담 |
다이소 영양제 판매 근황
|
9813 | 0 | 2025.03.05 |
| 448 | 잡담 |
다이소에서 파는...영양제 종류 ㄹㅇ...jpg
|
9780 | 0 | 2025.03.05 |
| 447 | 잡담 |
요즘 독감이 유행이라던데...🤧 명의가 알려주는 감기와 독감의 차이 #명의 #독감 #감기
|
357 | 0 | 2025.01.22 |
| 446 | 잡담 |
제로콜라 의학리뷰: 과연 문제가 있을까요 없을까요?
|
3273 | 0 | 2024.12.01 |