단축키
Prev이전 문서
Next다음 문서
단축키
Prev이전 문서
Next다음 문서
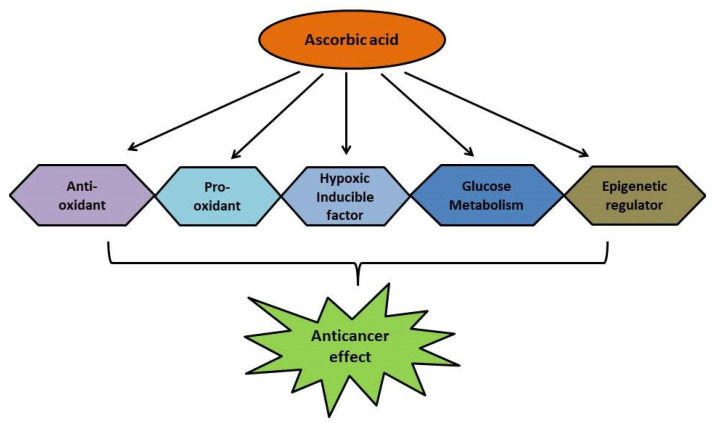
치명적인 질병인 암 역시 전 세계적으로 주요 사망 원인 중 하나이다. 암을 예방하고 치료하기 위한 다양한 발전에도 불구하고 항암제의 부작용은 여전히 큰 관심사로 남아 있습니다. 아스코르브산은 정상적인 생리 기능을 위해 우리 몸에 필요한 필수 비타민이며 항산화 및 항암 활성도 가지고 있습니다. 아스코르빈산은 신체에서 합성할 수 없지만 식품 및 기타 천연 공급원을 통해 자연적으로 풍부하며 영양 보충제로도 존재합니다. 항암제 개발에서 아스코르빈산은 활성 산소종(ROS) 제거, 선택적으로 ROS 생성 및 종양 세포에 대한 세포 독성 촉진, 포도당 대사 방지, 후성 유전적 역할 등 다양한 메커니즘을 통해 암 발병을 억제함으로써 중요한 역할을 해왔습니다. 조절제 및 종양 세포에서 HIF의 발현을 조절합니다. 항암 및 항산화 활성을 위해 현재까지 여러 아스코르브산 유사체가 생산되었습니다. 현재 검토에서는 아스코르브산의 항종양 활성 뒤에 숨은 메커니즘을 요약하고, 그 유도체와 항암제로서의 생물학적 활성을 정리하고, 리포솜, 암에 대한 나노입자와 같은 전달 시스템과 항암제로서 아스코르빈산에 대한 특허에 대해 논의합니다.
1. 소개
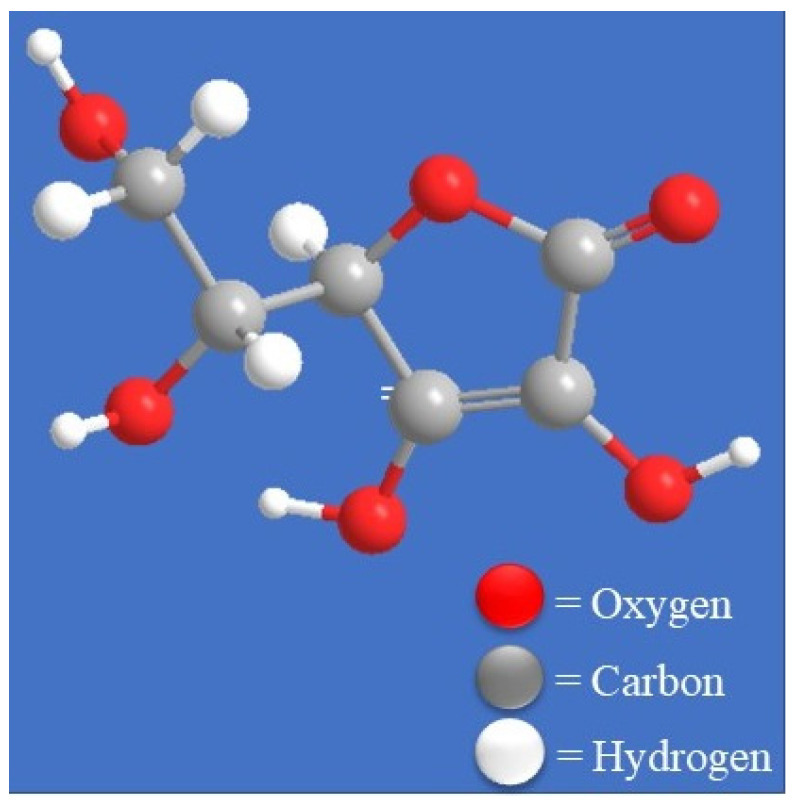
2018년 세계보건기구(WHO)는 960만 명이 암으로 사망한 것으로 추정했으며, 이로 인해 2040년까지 1,640만 명이 사망할 것으로 예상됩니다[ 1 , 2 ]. 사망률을 줄이고 생존율을 향상시키기 위한 암 연구가 진전되었음에도 불구하고 암은 여전히 사망자 6명 중 거의 1명을 차지하고 있으며 전 세계적으로 두 번째로 큰 사망 원인입니다[ 1 ]. 암을 예방하고 치료하기 위해 화학요법, 방사선요법, 수술 등 수많은 접근법이 있어 왔으며 일부 진전의 징후가 있었지만 선구적이고 효과적인 암 치료법을 개발할 필요성은 여전히 존재합니다[ 3 , 4 ]. 부작용 및 약물 부작용의 만연은 기존 암 치료법과 관련된 문제입니다[ 5 ]. 가장 흔한 부작용은 메스꺼움, 구토, 탈모, 설사, 빈혈, 피로, 식욕 및 체중 변화 등이며, 장기간 사용 시 영구적인 위장 기능 장애 및 생식기 손상을 일으킬 수 있다[ 6 , 7 ] . 따라서 암 치료를 위해서는 부작용이 적고 효과적인 신약을 찾는 것이 필요합니다. 아스코르브 산 (그림 1)는 우리 몸의 필수 미량 영양소로, 항산화제[ 8 , 9 , 10 ] 및 항암 활성[ 8 , 10 ]을 보유하고 있습니다.
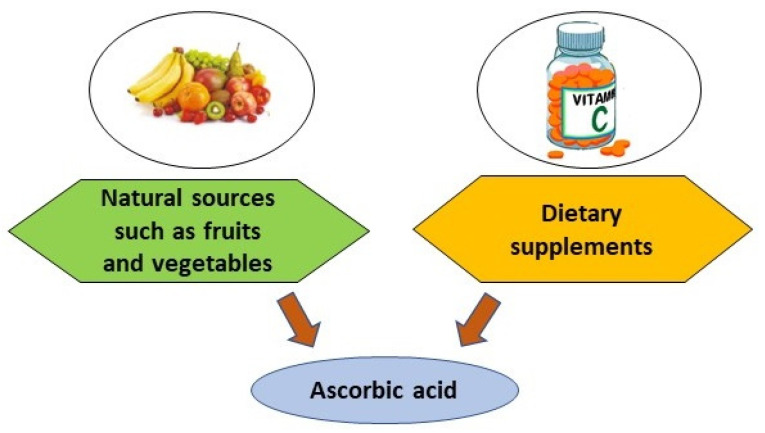
인간은 포도당과 갈락토오스로부터 아스코르브산을 생성하는 데 필요한 효소 글루코노락톤 산화효소가 없기 때문에 체내에서 아스코르빈산을 생산할 수 없습니다[ 11 ]. 그러므로 인간은 생리학적 필요를 충족시키기 위해 다양한 공급원으로부터 식단을 통해 아스코르브산을 섭취하는 것이 필수적입니다. 다음을 포함하는 인간의 식단을 위한 아스코르브산 공급원.
1.1. 천연 자원
아스코르빈산은 비타민 C로도 알려져 있으며 감귤류, 딸기, 토마토, 브로콜리, 브뤼셀 콩나물, 피망, 고추, 순무 및 기타 잎채소에서 널리 발견됩니다[ 12 , 13 , 14 ]. 생선과 우유에서도 소량이 발견되었습니다(그림 2) [ 12 ].
1.2. 식이 보충제
아스코르브산은 경구 현탁액용 분말, 캡슐, 경구 용액용 과립, 경구 용액용 분말, 정제, 경구 방울 및 단백질, 오메가-3 지방산, 설탕, 비타민 A, B1, B2, D, E, 메틸코발라민(B12), 피리독신(B6), 니아신(B3), 비오틴(B7), 판토텐산(B5), 엽산(B9), L-아르기닌, 칼슘, 구리 , 요오드, 철, 마그네슘, 인, 칼륨, 셀레늄, 나트륨 및 아연(그림 2) [ 15 ]. 때로는 식이 보충제에서 아스코르브산에 칼슘 아스코르베이트 또는 나트륨 아스코르베이트 형태의 미네랄 아스코르베이트가 포함될 수 있습니다[ 16 ].
복용량과 투여 경로에 따라 아스코르브산은 항산화 또는 항암 활성을 나타냅니다. 더 낮은 농도에서는 항산화제로 기능하고, 더 높은 약리학적 농도에서는 산화촉진제로서 기능합니다[ 10 ].
아스코르빈산은 산소, 질소, 황의 불안정한 자유 라디칼을 감소시키고 또 다른 항산화제인 토코페롤(비타민 E)의 활성을 강화함으로써 항산화제 역할을 합니다[ 17 ]. 따라서 아스코르브산은 자유 라디칼에 의해 유발된 산화로부터 DNA, 아미노산 잔기 및 지질을 보호하고 무결성을 유지하여 [ 18 ] 유해한 돌연변이를 방지합니다. 약리학 적 농도에서 아스코르브산은 유기금속 반응을 통해 암세포에서 H2O2를 생성하고 [ 19] 암세포 에 선택적 세포 독성을 유발합니다[ 19 ]. 암 사망의 약 90%는 전이에 기인합니다. 전이에서 암세포는 원발 종양 부위에서 혈액과 림프관을 통해 주변 조직과 먼 기관으로 퍼집니다[ 21 , 22 , 23 ]. 암은 원발 종양 부위를 넘어 퍼지면 매우 치명적이고 치료가 불가능해집니다[ 21 ]. 시험관 내 연구에서 고농도의 아스코르빈산은 세포 이동과 모세관 모양의 관 형성을 억제하는 것으로 관찰되었습니다[ 24 ]. 따라서 아스코르브산은 종양 세포의 추가 성장과 확산을 예방하는 데 유용할 수 있습니다. 또한, 아스코르빈산은 항산화제로서 활성산소로부터 우리 몸을 보호하고, 산화촉진제로서 암세포를 손상시킬 뿐만 아니라 콜라겐 형성, 상처치유, 신체조직의 회복, 뼈, 연골, 치아의 육성 [ 25 ]. 게다가, 아스코르브산은 정상 세포에 대한 독성이 덜하고[ 26 ] 저렴하고 쉽게 구할 수 있습니다. 따라서 항암제를 개발하는 데 이상적인 물질이 될 수 있습니다. 이 최신 리뷰는 암 치료법을 개선하기 위한 아스코르브산의 중요성에 중점을 두고 있습니다. 이 보고서는 최근 발전에 초점을 맞추고 다양한 세포주에서 항암제 및 항산화제로서 다양한 아스코르브 유도체의 생물학적 활성을 검토합니다.
2. 대사
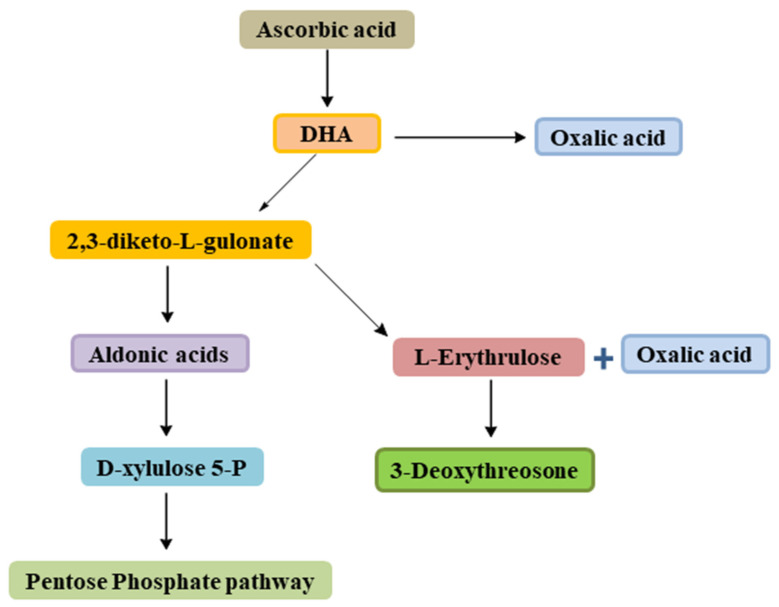
생리학적으로 아스코르브산은 L-아스코르브산과 L-데히드로아스코르빈산 구성으로 존재합니다[ 12 ]. 산화 시, L-데히드 로 아스코르브산은 비가역적으로 2,3-디케토-L-굴론산[12,13,27]을 생성하고 , 이는 C5 알돈산으로 전환된 다음 D-자일룰로스 5-P로 전환 됩니다 . 나중에 오탄당 인산 경로를 통해 주요 대사에 들어갑니다. 또한 2,3-diketo-L-gulonic acid도 L-erythrulose로 전환되고, 이는 다음으로 3-deoxythreosone으로 촉진 됩니다 . 대사 과정에서 복잡한 화학적 특성으로 인해 L-데히드로아스코르빈산은 신체 생리학 및 질병 병리학에 기여할 수 있는 여러 제품을 생산할 수 있습니다. 여기에는 수정체 단백질을 당화하는 반응제인 3-데옥시트레오손과 발육에 기여하는 옥살산염이 포함됩니다. 옥살산칼슘(calcium oxalate)을 형성하여 신장결석을 예방합니다.그림 3) [ 27 ]. 아스코르빈산의 대사산물은 주로 소변을 통해 제거됩니다[ 13 ]. 활성화를 위해 아스코르베이트를 세포 내로 수송하는 것을 중재하는 SVCT 역할을 여기서 언급하는 것이 적절합니다[ 28 ].
3. 구조적 특징
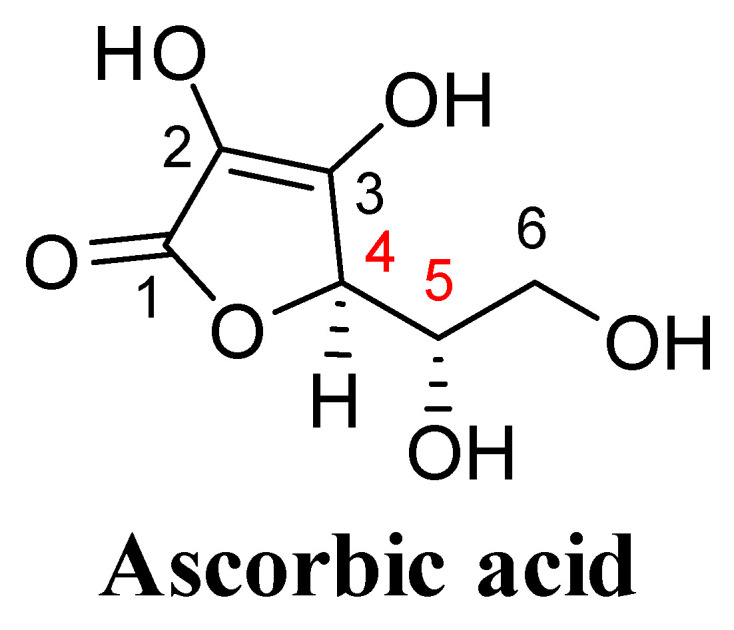
아스코르브산은 서로 다른 위치에 4개의 수산기를 포함하는 5원 감마-락톤 고리 당산입니다. C1 카르보닐기와 연결된 L-아스코르브산의 C2 및 C3 수산기는 C2 수산기 양성자(pK2 = 11.79)에 비해 C3 수산기의 양성자를 산성으로 만듭니다(pK1 = 4.25). 생리학적 pH에서는 아스코르베이트 음이온의 형태로 존재하는데, 이는 아스코르베이트 자유 라디칼로 산화되고 나중에 디히드로아스코르베이트로 산화되는 좋은 환원제입니다 [ 29 , 30 ]. C5 및 C6 수산기는 각각 알데히드 및 케톤과 반응하여 아세탈 및 케탈을 형성하는 전형적인 알코올 그룹입니다. L-아스코르빈산의 C4와 C5에 있는 두 개의 비대칭 중심은 양의 광학 회전을 담당합니다(그림 4) [ 29 ]. 두 개의 비대칭 중심은 또한 L-아스코르브산(4R, 5S), D-아스코르브산(4S, 5R), L-이소아스코르브산(4R, 5R) 및 D-이소아스코르브산(4S, 5S).
4. 암 치료에 대한 가능한 개입
1976년 Ewan Cameron과 Linus Pauling이 암 환자에게 아스코르브산을 투여하면 생존율이 높아진다고 보고했을 때[ 31 ] 아스코르빈산은 항암 활성을 가질 가능성이 있어 상당한 주목을 받았습니다. 그 후, 아스코르빈산의 항암 잠재력을 평가하기 위한 여러 연구가 승인되었습니다. 암에서는 영향을 받은 세포가 신체의 다른 부분에 있는 정상 세포를 더욱 침범합니다. 암세포에는 성장과 침입을 위한 여러 가지 보조물이 있습니다. 즉, 포도당 수송체(GLUT), 저산소증 유도 인자(HIF), 10-11 전위(TET) 단백질이 있습니다. GLUT는 포도당을 암세포로 운반하여 성장과 침입을 강화합니다.그림 5). HIF는 혈관 신생, 세포사멸 방지 활성, 줄기 세포 재생, 전이 및 암세포의 치료 저항성과 관련된 유전자의 발현을 조절합니다. TET 단백질은 세포의 대사 및 후성유전학적 프로필을 변경하여 암 줄기 세포의 활성화와 관련이 있습니다. 암에서 조절되는 경로와 함께 아스코르베이트의 새로운 특성을 찾는 것은 혁신적인 치료법의 선택과 개발에 도움이 될 것입니다. 항암 잠재력에 비추어 볼 때, 연구에서는 아스코르베이트가 GLUT, HIF 및 TET 메커니즘의 중요한 기능과 연관되어 있음을 뒷받침합니다. 여러 연구에서 아스코르브산이 다음과 같은 작용 메커니즘을 통해 암과 싸우는 것으로 나타났습니다.
4.1. 저산소증 유발 인자의 다운 조절자로서
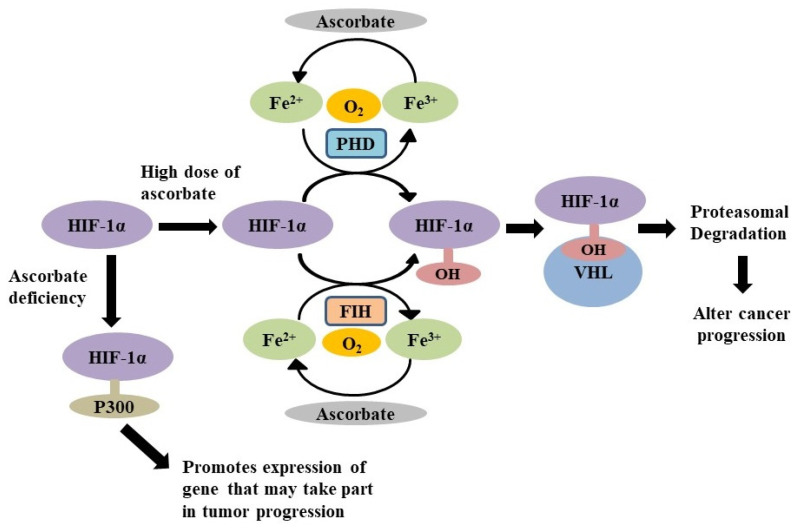
암 환자에서는 심각한 저산소증을 동반한 산소 결핍이 관찰되었습니다[ 32 ]. 세포의 지속적인 O 2 결핍은 저산소증 유도 인자(HIF)의 자극을 유도하여 [ 33 , 34 ], 이는 수많은 유전자의 발현을 변형시켜 혈관 신생 및 적혈구 줄기 세포의 발달을 초래합니다 [ 33 ]. 정상산소 환경에서 HIF 발현은 특수 산소 반응성 프롤릴 수산화효소 도메인 효소(PHD)에 의해 강력하게 제어됩니다. 이들 효소는 HIF의 프롤린 잔기를 수산화시키고 HIF 활성을 조절합니다[ 32 , 33 , 34 , 35 ]. 또한, 정상 산소 상태에서 HIF를 억제하는 인자(FIH)는 보조 활성화 인자 p300의 동원을 방해하여 HIF-1α의 전사 불활성화를 초래하는 HIF-1α의 아스파라긴 잔기 수산화를 통해 HIF-1α 활성을 조절 합니다 . PHD에 의해 유도된 수산화 과정은 von Hippel-Lindau(VHL) 단백질에 의한 유비퀴틴화된 HIF-1α의 프로테아좀 파괴에 관여하기 때문에 매우 중요합니다[ 34 , 35 , 37 ]. VHL 단백질은 수산화된 HIF를 식별하고 이에 결합한 다음 유비퀴틴 리가제를 축적하여 HIF-1α를 절단합니다[ 37 , 38 ]. PHD와 FIH는 산소를 기질로 사용하기 때문에 저산소 조건에서는 공정이 일어나지 않아[ 39 ] HIF가 활성화됩니다. PHD는 활성을 발휘하기 위해 철과 2-옥소글루타레이트가 필요한 이산소효소의 한 종류입니다[ 34 , 40 ]. 아스코르베이트는 철 이온(Fe 2+ ) 을 재활용하고 유지하기 위해 PHD에 대한 보조 인자 역할을 합니다 [ 40 , 41 ]. 따라서 아스코르베이트의 존재는 HIF 기능에 영향을 미칠 수 있으며, 이는 결국 종양 진행에 영향을 미칠 수 있습니다[ 40 ]. Wilkes 등은 약리학적 아스코르베이트가 HIF-1α의 분해를 유도하여 췌장암에서 전이성 발달을 감소시킨다는 것을 밝혔습니다[ 42 ]. 고용량에서 아스코르브산은 HIF-1α 수준의 분해를 통해 DNA 손상과 돌연변이를 감소시킵니다.그림 6) [ 43 ]. 이는 암세포에서 더 높은 용량의 아스코르베이트가 HIF 수산화효소의 작용을 강화하여 HIF-1α 활성을 억제하여 종양 성장을 억제한다는 것을 시사합니다.
4.2. 암세포의 포도당 대사 손상
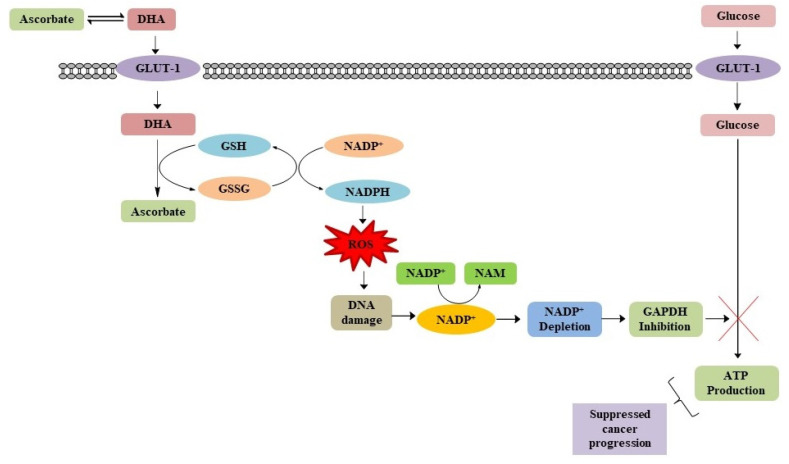
1900년대 초 Otto Warburg와 동료들은 풍부한 산소가 없을 때 종양 세포가 해당작용을 위해 더 많은 양의 포도당을 소비한다는 사실을 관찰했습니다. 이것은 Warburg Effect로 알려져 있습니다 [ 44 ]. 이는 저산소 환경에서 종양 생존 및 증식의 중요한 특징입니다[ 45 ]. 이러한 해당작용 특성의 변화는 종양 세포가 정상 세포보다 200배 더 빠른 해당작용 속도를 겪게 합니다[ 46 ]. Warburg 효과는 암세포의 중요한 대사 특성입니다[ 47 ]. Yu 등은 암세포에서 KRAS 또는 BRAF 유전자의 돌연변이가 Warburg 효과를 촉진하는 포도당 운반체-1(GLUT1) 유전자를 상향 조절한다는 것을 관찰했습니다[ 48 ]. 낮은 포도당 조건에서 암세포는 GLUT1의 선택적 상향 조절로 인한 증가된 해당작용을 통해 생존하며, 이는 암 치료를 위한 잠재적인 접근법이 될 수 있습니다 [ 49 ]. 정맥 내 고농도의 아스코르브산은 돌연변이된 KRAS 또는 BRAF를 선택적으로 방해하여 GLUT1의 해당작용 조절을 유도하고 암세포를 죽이는 것으로 인식되었습니다. 체내에 투여된 후 아스코르브산은 산화되어 탈수소아스코르베이트(DHA)로 전환됩니다[ 50 ]. 포도당과의 구조적 유사성으로 인해 DHA는 암세포에서 KRAS 또는 BRAF 돌연변이 GLUT1에 의해 흡수됩니다[ 41 ]. 일단 세포에 들어가면 DHA는 니코틴아미드 아데닌 디뉴클레오티드 인산(NADPH)과 글루타티온(GSH)이 있는 상태에서 다시 아스코르브산으로 환원됩니다[ 50 ]. 이러한 환원 과정에서 GSH와 NADPH가 각각 이황화 글루타티온(GSSG)과 산화된 니코틴아미드 아데닌 디뉴클레오티드 인산염(NADP+)으로 변경되면 세포 ROS가 발생합니다[ 50 , 51 ]. 증가된 ROS 수준은 글리세르알데히드 3-인산 탈수소효소(GAPDH)를 니코틴아미드(NAM)로 전환하는 데 중요한 보조 인자인 니코틴아미드 아데닌 디뉴클레오티드(NAD+)를 고갈시키는 폴리(ADP-리보스) 중합효소(PARP)의 활성화를 안내하는 DNA를 손상시킵니다. KRAS 또는 BRAF 돌연변이 세포에서 GAPDH가 방해를 받으면 에너지 부족이 발생하고 미토콘드리아가 ATP를 덜 생산하므로 세포 사멸이 이어집니다 . 위암과 신장암에서는 해당작용 활성이 높은 GLUT1의 발현이 높고 고용량의 아스코르베이트 처리에 민감하여 암세포를 선택적으로 사멸시키는 것으로 관찰되었습니다.그림 7) [ 52 , 53 ]. 따라서 아스코르브산은 포도당 대사를 손상시켜 암세포에 독성을 유발할 수 있습니다.
4.3. 후생적 조절자로서
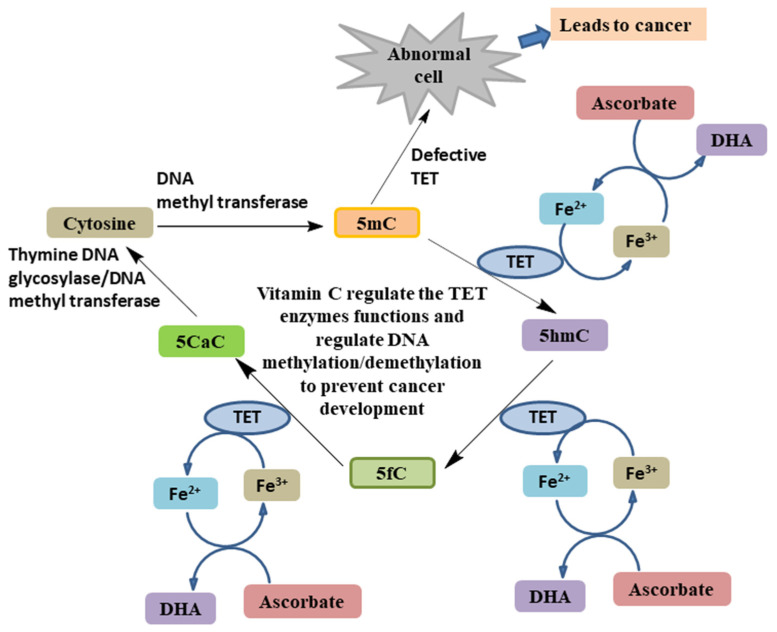
변경된 유전적 및 후생적 프로필은 암과 암 진행을 유발했습니다[ 54 ]. 후생적 변형에서는 DNA 서열에 직접적인 변화가 없습니다. 오히려 DNA 메틸화/탈메틸화와 같은 일련의 유전자 발현이 있습니다[ 55 ]. 저메틸화는 암 형성을 촉진하는 다양한 핵내 전사 인자를 유발하고 [ 56 ], 과메틸화는 종양 억제 유전자의 프로모터를 제한하여 종양 형성을 촉진합니다 [ 30 , 56 , 57 ]. TET(ten-eleven translocation) 단백질 계열의 돌연변이 및 발현 변경은 [ 45 ] 비정상적인 DNA 메틸화를 유발하여 암 형성에 기여합니다 [ 58 ]. 조혈 악성 종양에서는 TET(TET2)가 흔히 돌연변이됩니다[ 58 ]. TET 단백질은 철/α-케토글루타레이트 의존성 디옥시게나제(Fe 2+ /α-KGDD) 효소입니다[ 59 ]. 이 계열은 TET1, TET2 및 TET3 단백질로 구성됩니다[ 58 ]. 이러한 효소는 활성을 발휘하기 위해 보조 인자 아스코르브산이 필요합니다 [ 18 , 60 ]. TET 단백질은 5-메틸시토신(5mC)에서 5-히드록시메틸시토신(5hmC)으로의 전환을 촉매하며, 이는 이후 단계에서 알데히드로의 산화를 도와 5-포르밀시토신(5fC)을 형성하고 카르복실산을 형성하여 5-카르복실시토신(5CaC)을 형성 합니다 . 62 ]. 산화된 5fC와 5CaC는 티민 DNA 글리코실라제 효소의 존재 하에서 염기 절단 메커니즘을 거쳐 시토신으로 변환 됩니다 . TET의 효소 활성 전반에 걸쳐 아스코르베이트는 Fe 3+ 를 Fe 2+ 로의 회복을 촉진하는 보조인자 역할을 합니다 .그림 8) [ 64 ]. 급성 골수성 백혈병(AML) 및 만성 골수성 백혈병(CMML)과 같은 다양한 유형의 혈액학적 악성 종양은 TET2의 돌연변이 유발 촉매 활성 방해와 관련이 있습니다[ 65 ]. Shenoy 등은 림프종 환자의 아스코르브산이 종양 억제 유전자 SMAD1의 억제를 증가시키고 화학민감성을 개선함으로써 TET 기능을 변형시키는 것을 관찰했습니다[ 60 ]. AML 세포 및 TET2 결실 마우스 모델에서 아스코르브산은 DNA 저메틸화 및 증가된 TET 활성을 유도합니다 [ 59 ]. 따라서 TET 효소는 암 진행의 중요한 주역을 차단하고 아스코르베이트 접근성은 이들의 활동에 영향을 미칩니다.
4.4. 항산화제로서
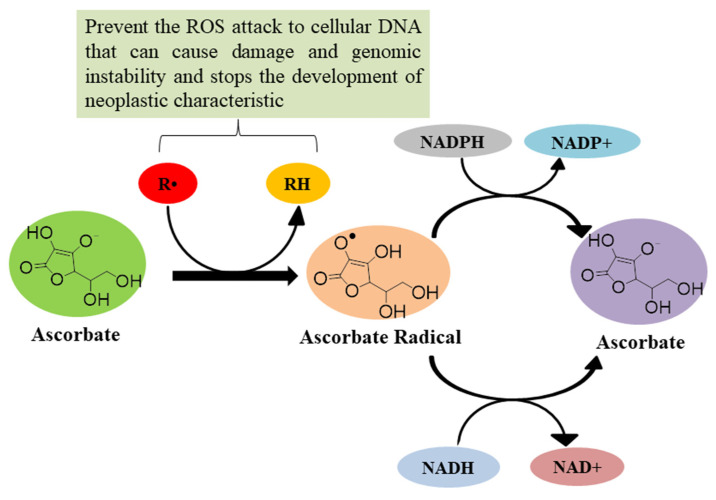
인체에서는 생리학적 및 병리학적 과정에서 활성산소종(ROS)이 생성되지만[ 66 , 67 ], 높은 수준의 ROS는 발암에 기여합니다[ 68 ]. ROS는 세포 DNA를 공격하여 손상과 게놈 불안정성을 유발하고 종양성 특성의 발달을 통합하는 돌연변이를 유발합니다[ 69 , 70 ]. 건강한 사람의 경우 혈장 농도 40~80μM의 아스코르베이트는 항산화 활성을 나타냅니다. 이 농도에서 아스코르베이트는 자유 라디칼에 전자를 기증하고 잠재적인 손상 효과를 감소시킵니다 [ 30 ]. 이 과정에서 아스코르베이트는 그 자체로 상당히 반응하지 않는 아스코르베이트 라디칼로 산화되며, 이는 NADH/NADPH 의존성 환원효소를 통해 다시 아스코르베이트로 전환됩니다.그림 9) [ 30 ]. 비타민 E와 결합된 아스코르베이트는 ROS로 인한 지질 과산화로부터 LDL을 보호하는 공동 항산화제로서 시너지 효과를 발휘하고 [ 30 ] 공정의 최종 생성물인 4-하이드록시노네날(HNE)의 형성을 방지합니다. 산화 스트레스의 2차 전달자 [ 45 ]. 아스코르베이트는 또한 지질 산화를 억제한 후에도 체내 비타민 E 수준을 유지합니다 [ 71 ]. 또한 화학요법 중 항산화제로서 아스코르빈산을 보충하면 치료에 대한 종양 반응이 증가하고 생존율도 증가합니다[ 72 ]. Suh 등은 시험관 내에서 아스코르베이트가 철로 인한 지질 과산화를 방지하여 항산화제 역할을 한다는 것을 관찰했습니다[ 73 ]. Chen 등은 철분 과잉이 있는 기니피그에게 경구로 보충된 아스코르베이트가 지질 산화를 억제하여 항산화제 역할을 한다고 보고했습니다[ 74 ]. 따라서 낮은 농도의 아스코르빈산은 항산화제 역할을 하여 자유라디칼로 인한 신체 손상을 예방하고, 화학 요법의 효과를 높여 비타민 E의 분해를 방지합니다.
4.5. 산화 방지제 역할
마이크로몰(μM) 농도의 아스코르브산은 항산화제로 기능하지만, 더 높은 밀리몰(mM) 농도에서는 산화 촉진제로도 기능합니다. 비타민 C의 정맥 투여는 경구 투여보다 70배 더 높은 혈장 농도를 생성할 수 있기 때문에 종양 세포에 대한 세포 독성을 유도합니다 [ 75 ] . 고용량 아스코르브산의 항종양 잠재력은 과산화수소(H 2 O 2 )를 생성하는 능력에 뿌리를 두고 있는 것으로 관찰되었습니다[ 77 ]. 동물에서 밀리몰 농도의 아스코르베이트는 구리와 철 금속에 전자를 기증하여 과산화수소와 유사한 ROS인 과산화물을 생성합니다[ 20 ]. ROS는 DNA 손상을 유도하여 궁극적으로 암세포에 세포 독성을 유발합니다 [ 55 ]. 정맥 투여 시 아스코르브산염(AscH-)은 단백질 중심의 전이 금속 이온, 즉 철(Fe 3+ ) 및 구리(Cu 2+ ) 이온과 반응합니다. 실제로는 전환 금속의 수준이 상당히 낮으므로 더 높은 농도의 비타민 C가 필요합니다. 아스코르브산염은 Fe 3+ /Cu 2+를 철(Fe 2+) /구리(Cu+) 이온으로 환원시켜 그 자체를 아스코르베이트 자유 라디칼(Asc−)로 산화시킵니다. 환원된 Fe 2+ /Cu+ 이온은 산소와 반응하여 과산화물 라디칼과 같은 ROS를 형성하며, 이는 수소 존재 시 불균일화를 거쳐 과산화수소(H 2 O 2 )를 형성합니다. 또한, H 2 O 2 는 Fe 2+ /Cu+ 에 의해 촉매되는 Fenton 유사 반응을 거쳐 과산화수소 라디칼(HO⋅)을 생성할 수 있으며[ 30 , 55 ], 이는 암세포에 손상을 유도합니다[ 78 ].
종양 조직의 간질액에는 단백질이 포함되어 있고[ 79 ], 세포외액에는 손상된 단백질에 철, 구리 등의 촉매 금속이 포함되어 있는 것으로 보고되었습니다 [ 80 ]. 정상 내피와 비교하여 종양 혈관은 더 큰 투과성을 가지며[ 79 ], 이는 촉매 전환에 필요한 금속 이온을 증폭시키고 아스코르브산이 H2O2로 변환되는 것을 향상 시킵니다 [ 80 ] . 여러 연구에서 암에서 구리 수치가 증가했다고 보고했습니다[ 81 , 82 ]. 이는 빠르게 증식하는 암세포를 위한 DNA 복제 효소의 보조 인자이기 때문입니다[ 55 ]. 암에서는 원소의 전신 분포가 변경되어 구리 농도가 높아지면[ 83 ] 암세포가 ROS에 의해 생성된 구리 및 아스코르브산의 선택적 세포 독성에 취약해졌습니다[ 84 ]. 또한 철의 경우 건강한 사람의 경우 당단백질 페리틴에 의해 저장되지만 암 염증과 같은 병리학적 상태에서는 세포외 철 킬레이트가 조직에서 증가하여[ 85 ] 아스코르베이트 유발 ROS 독성에 취약합니다.
Chen 등은 아스코르브산이 H 2 O 2 생성을 통해 정상 세포에 손상을 주지 않으면서 종양 성장을 선택적으로 방해한다는 사실을 관찰했습니다 [ 19 ]. Baek 등은 또한 아스코르브산이 ROS 생성을 통해 암세포에 독성을 유도한다는 사실을 관찰했습니다[ 86 ]. 또 다른 연구에서는 다량의 아스코르빈산이 ROS, 특히 과산화수소 생성을 통해 악성 세포의 세포 사멸을 촉진했다고 합니다[ 87 ]. 따라서 밀리몰 농도의 아스코르브산은 ROS의 생성을 통해 다양한 암세포에 독성을 유발하며, ROS는 그 자체로 세포 구성 요소를 손상시키고 다양한 중요한 세포 메커니즘을 방해합니다.
5. 암에 대항하는 아스코르빈산의 강력한 합성 유도체
L-아스코르브산은 대체 가능한 취약한 부위가 거의 없으며 흥미로운 화학적, 물리적, 생물학적 특성을 지닌 화합물의 총합을 생성합니다. C2, C3, C5 및 C6 위치로 치환된 아스코르브산 유사체에 대한 이전 설명은 다양한 연구에서 보고되었습니다[ 88 , 89 ]. 항암제로서 새로운 아스코르브산 유사체를 설계하는 것은 위에 언급된 부위 중 어느 곳에서 유도체화하고 간세포 암종(HepG2), 대장 선암종(SW620), 폐 선암종(A549)과 같은 일부 세포주에 대한 활성을 평가한 후에 이루어집니다. ), 대장암종(HCT-116), 유방 선암종(MCF-7), 자궁경부암종(HeLa), 관췌장선암종(CFPAC-1), 쥐 결장암종(Colon-26), 쥐 백혈병(L1210), 췌장암종 (MiaPaCa-2), 급성림프구성백혈병(CEM), 버킷림프종(Raji line), 골수종(CCL155), 대장암세포(HT29), 간암세포(HuH7), 전립선암세포(PC3), 비소세포 폐암종(H-460). 다음은 항종양제 및 항산화제로 평가되는 일부 아스코르브산 유사체입니다.
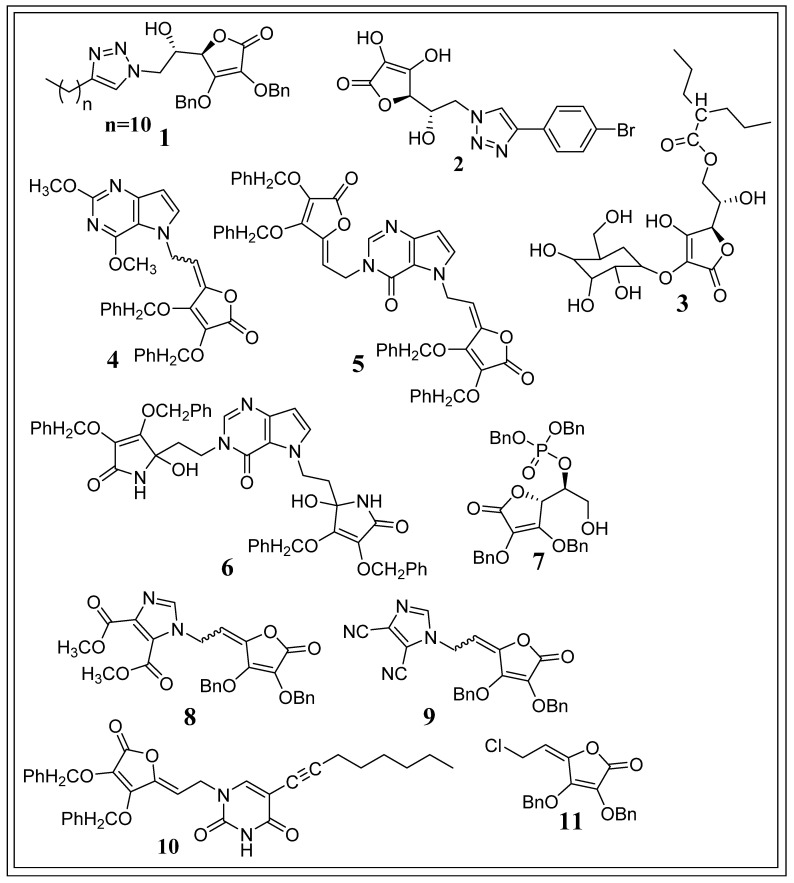
Macanet al. (2019)은 6-(1,2,3-트리아졸릴)-2,3-디벤질-L-아스코르브산 유사체의 두 서열을 합성했습니다. 새로 합성된 6-(1,2,3-triazolyl)-6-deoxy-L-ascorbic acid 및 6-(1,2,3-triazolyl)-4,5-didehydro-5,6-dideoxy-L-ascorbic acid 항증식 활성에 대해 산 유사체를 평가했습니다. 합성된 모든 유도체 중에서 화합물 1 (그림 10) (2,3-O, O-디벤질-6-(4-데실-1,2,3-트리아졸-1-일)-6-데옥시-L-아스코르브산)은 주로 유방 선암종에 대해 강한 세포 증식 억제 활성을 나타냈습니다. 세포주(IC 50 = 0.08 µM)에 독성을 나타내지만 정상 섬유아세포에는 독성을 일으키지 않습니다(IC 50 > 100 mM). 화합물 1은 HIF-1α 신호 전달 경로의 조절을 통해 세포독성을 유도합니다[ 90 ].
Harejet al. (2019)은 하이드록시 에틸렌 링커를 사용하여 새로운 4-치환 1,2,3-트리아졸 L-아스코르브산 유도체를 합성하고 항증식 작용을 평가했습니다. 합성된 모든 유도체 중에서 화합물 2 (그림 10) (6-[4-(4-브로모페닐)-1,2,3-트리아졸-1-일]-6-데옥시-L-아스코르브산)은 유방 선암종 세포에 대해 가장 높은 선택적인 항증식 활성을 나타냈습니다(IC 50 = 6.72 μM). 또한, 화합물 2 는 포피 섬유아세포에 대해서는 세포독성이 없었고 폐 섬유아세포에 대해서는 세포독성이 거의 나타나지 않았습니다(IC 50 = 73.93μM). 화합물 2 (IC 50 = 6.72 μM)는 MCF-에 대해 기준 화합물 카르복시아미도트리아졸(IC 50 = 14.69 μM)보다 세포 독성이 높았으나 기준 화합물 5-플루오로우라실(5-FU)(IC 50 = 0.096 μM) 보다 낮았습니다. 7개의 세포주. 화합물 2는 HIF-1에 의해 유발된 저산소증을 통해 MCF-7 세포에 대해 세포독성을 나타내는 것으로 밝혀졌습니다 [ 91 ].
Miuraet al. (2018) 합성 2-O-α-D-글루코피라노실-6-O-(2-펜틸헵타노일)-L-아스코르브산(화합물 3 )(그림 10) 세포 및 종양 보유 동물 모델에 대한 항종양 활성을 평가했습니다. 합성된 유도체는 2 mM 농도에서 colon-26 세포에 대한 세포독성을 나타내지 않는 것으로 보고되었습니다. 그러나 격일로 1.7mmol/kg의 정맥내(IV) 용량을 4회 투여했을 때 화합물 3은 대조 물질인 아스코르브산 및 2-O-α-D-글루코피라노실-L-아스코르브산보다 종양 진행을 더 강력하게 억제했습니다. , 대조 물질 투여량 몰량의 10%만을 차지함에도 불구하고 꾸준한 아스코르브산 유도체입니다. 이 연구는 투여 후 화합물 3이 대사 산물인 AA-2G로 전환되어 나중에 DHA로 산화되고 유도를 통해 암세포를 선택적으로 죽이고 내인성 산화 스트레스를 증가시키는 것을 시사했습니다[ 92 ].
Babicet al. (2015)은 L-아스코르브산 및 이미노-L-아스코르브산의 새로운 할로겐화 3-데아자퓨린, 7-데아자퓨린, 알킬화 9-데아자퓨린 유사체를 합성했습니다. 새로 생성된 유도체의 항종양 활성을 평가한 결과 합성된 모든 유사체 중에서 화합물 4 (그림 10), L-아스코르브산의 9-데아자푸린 유사체는 CEM 세포에 대해 가장 높은 억제 활성(IC 50 = 4.1 ± 1.8 μM)을 나타냈고 L1210 세포에 대해 강력한 억제 활성(IC 50 = 4.7 ± 0.1 μM)을 나타냈습니다. 또한, 화합물 5 (그림 10) L-아스코르브산의 9-데아자히폭산틴 유사체는 HeLa 세포에 대해 가장 높은 항증식 활성(IC 50 = 5.6 ± 1.3 μM)과 L1210 세포(IC 50 = 4.5 ± 0.5 μM)에 대해 강력한 억제 활성을 입증한 반면, 화합물 6 (그림 10), 두 개의 이미노-L-아스코르브산 잔기를 갖는 이치환된 9-데아자퓨린 유사체는 L1210 세포 및 MiaPaCa-2 세포에 대해 가장 강력한 억제 활성을 나타냈습니다(각각 IC 50 = 4.4 ± 0.3 μM, IC 50 = 5.7 ± 0.2 μM) . 또한, 화합물 4 , 5 , 6은 표준 약물인 5-플루오로우라실(28.3 ± 0.01 μM)과 비교하여 쥐 배아 섬유아세포인 3T3(IC 50 > 100 μM)에 대해 세포독성이 없었습니다[ 93 ].
Bordignonet al. (2013)은 퓨라닉 고리에 인산염 또는 아데닌 측쇄를 첨가하여 ATP와 유사한 구조를 생성하는 아스코르브산 유도체를 합성하고 이들의 항증식 활성을 평가했습니다. 합성된 유도체 중에서 화합물 7 (그림 10) (디벤질 (S)-1-[(R)-3,4-비스(벤질옥시)-5-옥소-2,5-디하이드로푸란-2-일]-2-하이드록시에틸 포스페이트)는 HuH7에 대해 가장 높은 세포독성을 나타냈고, HT29, Raji 및 CCL155 세포주(IC 50 = 0.1 ± 0.002, 0.15 ± 0.011, 0.086 ± 0.004 및 0.1 ± 0.005 mM, 각각)는 정상 인간 세포에 대해 세포 독성을 일으키지 않습니다. 화합물 7은 2개의 서로 다른 인간 종양 세포주인 HT29 및 PC3을 사용하여 이종이식된 동물에 대해 추가로 연구되었습니다. 10 mg/kg/d 용량에서 PC3 이종이식 마우스의 화합물 7은 종양 발생 및 종양 무게를 현저히 낮추어 연구가 종료될 때 모든 화합물 7 처리 마우스 의 생존을 가져온 반면, 위약 처리 마우스 10마리 중 6마리만이 남아 있었습니다. 살아 있는. 연구자들은 또한 화합물 7이 번역 개시 인자와 tRNA 합성효소의 발현을 억제함으로써 종양을 억제한다는 것을 지적했습니다[ 94 ].
Wittineet al. (2012)은 새로운 1,2,4-트리아졸 L-아스코르브산, 이미다졸 L-아스코르브산 및 이미노-아스코르브산 유도체를 합성하고 이들의 항종양 특성을 평가했습니다. 합성된 모든 유도체 중에서 화합물 8 과 9 (그림 10)은 완전히 사용된 종양 세포주에 대해 가장 뚜렷한 세포증식 억제 효과를 나타냈으며 CEM/0 세포에 대해 선택적으로 세포독성을 나타냈습니다(IC 50 은 각각 10 ± 4 및 7.3 ± 0.1 μM). 화합물 9 는 화합물 8 보다 활성이 더 높았 지만 화합물 8 ( IC 50 = 73 ± 0.5 μM) 과 달리 인간 정상 섬유아세포(IC 50 > 100 μM) 에 대해 세포독성을 나타내지 않았습니다 . 화합물 8 과 9는 모두 CEM/0 세포에 대한 참조 약물 독소루비신(IC 50 = 0.39 ± 0.21 μM)보다 세포 독성이 적었지만 다른 참조 약물인 리바비린(IC 50 = 63 ± 14 μM) 보다 더 높았습니다 . 그들은 또한 화합물 8이 이노신 5'-모노포스페이트 탈수소효소(IMMPH)의 억제를 통해 항종양 효과를 나타내는 것을 관찰했습니다[ 95 ].
Gazivodaet al. (2007)은 두 가지 시리즈의 새로운 C-5 알키닐화 피리미딘과 아스코르브산의 융합된 이환식 푸로[2,3-d]피리미딘 유사체를 합성했습니다. 새로 합성된 화합물의 세포증식억제 활성을 평가한 결과, 합성된 모든 유도체 중에서 화합물 10 (그림 10)는 Molt4/C8, CEM, MiaPaCa-2, SW 620, MCF-7 및 H-460 세포주에 대해 가장 높은 세포 증식 억제 활성을 나타냈습니다(IC 50 = 3.0 ± 1.1, 2.0 ± 0.3, 3 ± 0.5, 4 ± 0.3, 각각 4 ± 1.4 및 2.4 ± 0.4 μM) [ 96 ].
Gazivodaet al. (2006)은 5,6-di-O-변형된 L-아스코르브산 유사체를 합성하고 세포 증식 억제 활성을 평가했습니다. 합성된 전체 화합물 중 Z-2,3-Di-O-benzyl-6-클로로-4,5-didehydro-L-ascorbic acid(화합물 11 )(그림 10)는 IC50 이 18 ± 1μM인 모든 악성 종양 세포에 대해 탁월한 항종양 활성을 나타냈으며 , 동시에 인간 정상 이배체 섬유아세포(WI 38)( IC50 = 26 ± 1μM)에 대해 세포독성을 나타냈습니다[ 97 ].
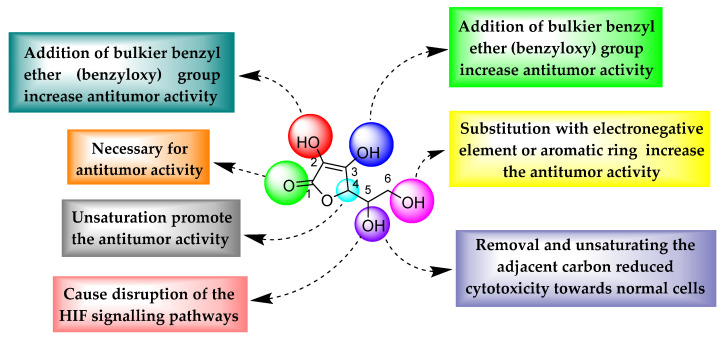
위의 모든 유도체로부터 2,3-히드록실기를 부피가 큰 벤질 에테르(벤질옥시)기로 보호하면 극성이 감소하고 결과적으로 유도체의 항종양 활성이 촉진되는 것으로 관찰되었습니다. C1 카르보닐 산소는 항종양 효과를 발휘하는 데 필수적입니다. 화합물 4 , 5 , 8 , 9 , 10 및 11 (그림 10), C4 탄소의 불포화가 항종양 활성을 더욱 증가시키는 것으로 관찰되었습니다. 6번째 위치에서 전기 음성 원소 또는 방향족 고리로의 치환은 항종양 활성을 증가시켰다. 위치 2, 3, 5, 6에서 전자를 끄는 그룹으로의 치환 또는 변경은 아스코르브산의 항종양 잠재력에 필수적입니다.그림 11).
6. 암치료의 새로운 동향
치료 효과를 향상시키기 위한 요구로서 분자를 다른 캡슐화된 전달 시스템으로 통합하는 것이 중요합니다. 이는 분자를 화학적 분해로부터 보호하기 때문입니다[ 98 ]. 다양한 연구에서 아스코르브산과 그 유사체가 캡슐화된 전달 시스템에 성공적이고 효과적으로 통합된 것으로 나타났습니다. 이들 중 일부는 아래에 설명되어 있습니다.
6.1. 리포솜
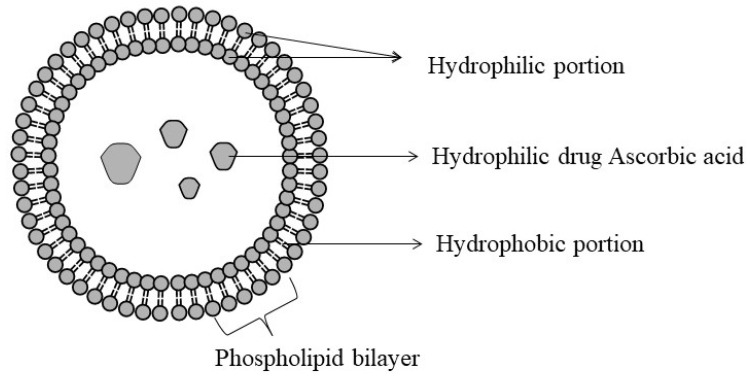
리포솜은 천연 또는 합성 인지질과 콜레스테롤로 생성된 생분해성 작은 인공 구형 소포입니다[ 99 , 100 ]. 리포솜을 구성하는 인지질과 콜레스테롤은 친수성 머리와 친유성 꼬리로 구성된 양친매성입니다[ 100 , 101 ]. 극성 머리와 소수성 꼬리는 각각 소수성 영역과 친수성 영역에 지용성 성분과 수용성 성분을 포집하는 데 도움이 되는 이중층을 형성합니다[ 100 ]. 따라서 소수성과 친수성 특성으로 인해 [ 99 ] 약물, 약초 및 단백질의 약동학적 특성을 조정할 수 있습니다(그림 12) [ 100 ].
Filipczak 등은 암모늄 아스코르베이트, 미톡산트론(MTX) 및 아나카르드산으로 구성된 리포솜을 개발했습니다. 발명된 리포솜 제제는 철 이온 메커니즘에 의한 자유 라디칼의 특정 생성을 통해 흑색종 세포주의 세포사멸 수준을 선택적으로 확대했습니다. 형태학적 연구에 따르면 직경이 102~120nm 사이인 일관된 원형 모양이 나타났습니다. 리포솜 포획 약물은 유리 약물에 비해 Hep-G2 및 H9C2 세포주에 대한 독성이 낮습니다. 리포좀 투여 12시간 후 A375 흑색종에 대한 카스파제 활성이 8배 증가하여 과도한 활성산소가 생성되어 세포 사멸을 초래했습니다[ 102 ].
Yang 등은 독소루비신(DOX)과 팔미토일 아스코르베이트(PA)의 리포솜을 개발했습니다. 일부 종류의 암 치료법에서 PA는 DOX로 인한 독성을 감소시킵니다. 고농도의 리포솜은 ROS 생산의 증가된 양을 생성하고 세포사멸의 시작을 유도합니다. 형태학적 연구에 따르면 리포솜은 직경이 91~137.5 nm 범위인 구형이고 균질한 것으로 확인되었습니다. PA는 생체 내에서 혈장 반감기를 연장시키기 때문에 약물 보유 기간을 연장하는 데 도움이 됩니다. PA와 독소루비신을 함유한 리포솜은 용액에 DOX와 DOX를 함유한 리포솜에 비해 종양의 무게와 크기를 각각 2.5배와 5배 줄였습니다[ 103 ].
Li 등은 항종양 치료를 위해 팔미토일 아스코르베이트(PA)와 도세탁셀(DC)의 리포솜 공동 전달 시스템을 개발했습니다. 시너지 효과를 내기 위해 PA는 세포독성 화학요법(DOC)과 함께 사용되어 효능과 세포독성 활성을 향상시켰습니다. 약물이 로딩된 리포솜은 입자 크기가 140~170 nm 범위로 균일했습니다. 시험관 내 테스트에서 200:1 중량비로 PA와 DC로 구성된 리포솜은 MCF-7, PC-3 및 HepG2 세포주에 대해 최대 시너지 효과를 발휘했습니다. 또한, 이들은 약물 단독으로 구성된 리포솜보다 생체 내에서 종양 세포 진행을 더 효율적으로 억제했습니다[ 104 ].
Lipka 등은 아스코르브산과 암모늄 아스코르베이트 염 구배를 사용하여 공동 캡슐화된 에피루비신(EPI) 리포솜을 개발했습니다. 항종양제인 EPI는 토포이소머라제 II를 방해하여 DNA 및 RNA 합성을 억제하고 자유 라디칼을 발생시키기 쉬워 암세포에 독성을 유발합니다. 약물이 탑재된 리포솜은 112~123 nm 범위의 입자 크기로 균일합니다. 유리 EPI의 혈장 소멸은 리포솜 캡슐화 약물에 비해 매우 빠릅니다. 자유 약물의 경우 15분 후에도 혈장에 1%만 남아 있는 반면, 캡슐화 약물의 경우 24시간 후에도 약 40%가 여전히 남아 있습니다. 아스코르브산 구배를 갖는 리포솜 캡슐화된 EPI는 유방암 4T-1 쥐 모델에 대해 생체 내에서 인상적인 항종양 활성을 나타냈습니다[ 105 ].
6.2. 나노입자
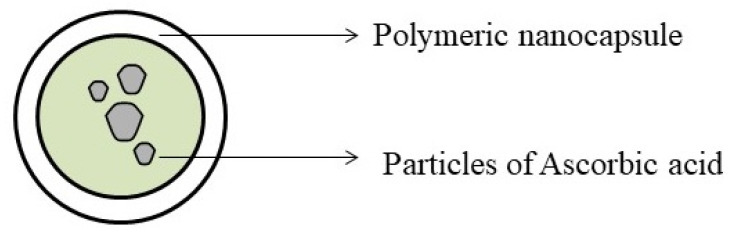
나노입자(NP) (그림 13)은 일반적으로 1~100nm 범위의 입자 크기를 갖는 광범위한 물질로 구성된 입자입니다[ 106 , 107 ]. 연구자들은 물질의 물리화학적 특성이 입자 크기에 영향을 받는다는 것을 관찰했습니다[ 106 ]. 세포는 1~10μm 크기의 물질을 흡수합니다[ 108 , 109 ]. 따라서 나노입자는 크기로 인해 조직에 쉽게 들어가고 세포에 흡수되어 부작용이 감소되거나 미미한 표적 위치에서 효과적인 약물 작용을 보장합니다[ 110 ]. 치료학적으로 나노입자는 동봉된 화합물의 용해, 약물 표적화, 흡수 및 분해를 개선하고 약물의 방출을 제어하는 데 사용됩니다[ 111 ].
Zhou 등은 2017년에 아스코르빌 팔미테이트(AP)와 파클리탁셀(PTX)을 캡슐화하고 B16F10 세포주에 대한 항암 잠재력을 평가함으로써 시너지 효과가 있는 암 치료를 위한 이중 약물 전달 접근법을 갖춘 나노입자를 개발했습니다. 동적 광 산란 및 투과 전자 현미경(TEM)을 통해 평균 직경이 223 nm이고 동일한 제타 전위를 갖는 나노입자의 구형 프로파일을 확인했습니다. 시험관 내 연구에서는 AP와 PTX를 2:1 비율로 함유한 AP/PTX-고체 지질 나노입자(AP/PTX-SLN)가 AP와 PTX의 흡수 및 세포 투과성이 향상되어 이상적인 항암 시너지 효과를 나타내는 것으로 나타났습니다. 이에 비해, 생체내 연구에서는 B16F10 종양 보유 마우스에서 AP/PTX-SLN이 폐의 종양 성장을 효과적으로 억제하고 Bcl 감소를 통해 유일한 약물이 함유된 SLN보다 암세포를 더 효과적으로 제거하는 것으로 나타났습니다. -2/Bax 분수. 또한, AP/PTX-SLN을 사용한 연구 전반에 걸쳐 뚜렷한 부작용이 관찰되지 않았습니다[ 112 ].
2014년에 Guney 등은 암세포에 효과적인 AA 전달을 위해 고온 균질화 기술을 사용하여 고체 지질 나노입자(SLN)에 아스코르브산(AA)을 포집하고 H-Ras 5RP7 세포주에 대한 항암 잠재력을 평가했습니다. Nano Zetasizer ZS 및 HPLC는 입자 직경이 50~250nm이고 동일한 제타 전위를 갖는 AA-SLN의 구형 모양을 특성화했습니다. AA-SLN은 무료 AA에 비해 콘텐츠를 더 안정적으로 출시하여 60분 내에 출시된 무료 AA의 약 90%에 비해 96시간 동안 최대 70%까지 출시되는 것으로 나타났습니다. 25μM/mL 농도에서 AA-SLN은 AA-SLN으로 조사한 세포에서 활성 카스파제-3 함량을 40.5%인 것과 비교하여 최대 68.5%까지 축적함으로써 H-Ras 5RP7 세포에 대해 41%의 세포 생존율로 최대 세포 독성 효과를 나타냈습니다. 72시간 후 AA에 의한 카스파제-3. 또한, AA-SLN은 대조 계통 NIH/3T3 세포에 대해 유의미한 세포독성을 나타내지 않았습니다[ 113 ].
Sawant 등은 2010년에 팔미토일 아스코르베이트(PA)의 리포솜 나노입자를 제조하고 쥐의 유방 암종 4T1 세포에 대한 시험관 내 및 생체 내 항암 가능성을 평가했습니다. 동적 광 산란(DLS)은 PA 리포솜의 입자 크기가 146.6 ± 29.0 nm임을 나타냅니다. 시험관 내 연구에서는 과산화물 생성이 PA 리포솜의 항암 잠재력을 향상시키는 것으로 나타났습니다. 또한, 4T1 종양 보유 쥐에 대한 생체 내 연구에서는 20mg/kg 용량의 PA 리포솜이 파클리탁셀 리포솜에 비해 종양 성장을 현저히 억제하는 것으로 나타났습니다[ 114 ].
Martins 등은 2010년에 비올라신을 함유한 폴리-D,L-(락타이드-코-글리콜리드)의 아스코르브산으로 덮인 나노입자를 준비하고 백혈병 HL-60 세포에 대한 항종양 활성도 평가했습니다. 광자 상관 분광학은 300~550 nm 범위의 직경과 동일한 음의 제타 전위를 갖는 나노입자의 구형 형태를 결정했습니다. 비올라신 방출 동역학 분석에서는 분석 초기 3시간 동안 나노입자의 초기 폭발이 관찰되었으며, 분석 72시간 후에는 최대 80%의 꾸준한 방출에 이어 40~60%의 약물이 방출되었습니다. MTT 분석 결과, AA-바이올라신 나노입자는 IC 50 값이 0.2 μM로 HL-60 세포에 대해 더 나은 세포 독성을 나타냈으며, 이는 유리 바이올라신(IC 50 = 0.5 μM)보다 2.5배 더 활성이 높았습니다[ 115 ].
Frungillo 등은 2009년에 트랜스-디하이드로크로토닌(DHC)과 L-아스코르브산 6-스테아레이트(AAS)가 포함된 나노입자를 준비하고 HL60 세포에 대한 시험관 내 항종양 활성을 평가했습니다. 광자 상관 분광법은 동일한 음의 제타 전위를 갖는 110~140nm 사이의 크기를 확인했습니다. 시험관 내 방출에 대한 동역학 분석에서는 분석 6시간 후에 유리 DHC가 용해되는 것으로 나타났습니다. 이에 비해 AAS와 DHC(NP-AAS-DHC)가 로딩된 나노입자는 최대 72시간까지 꾸준한 방출을 보여주었습니다. HL-60 세포에 대한 NP-AAS-DHC의 세포독성 효과는 MTT 및 Trypan blue 배제 분석으로 평가되었으며, IC 50 이 각각 140 및 90 μM인 것으로 나타났습니다[ 116 ].
7. 항암제로서의 특허
지난 수십 년 동안 몇 가지 근본적인 발견은 향후 활용을 위한 매우 현실적인 기회를 갖춘 지적 재산으로 전환되었습니다. 결과적으로, 아스코르빈산 및 그 유도체의 항암 잠재력과 관련된 새롭고 혁신적인 제품과 기술이 특허를 받았습니다. 다음은 그러한 특허의 몇 가지 예입니다(1 번 테이블):
8. 과제 및 현황
아스코르빈산을 활용하려면 높은 pH, 수성 매질, 산소 및 금속 이온에 노출되면 단순히 분해되기 때문에 안정성이 주요 과제입니다. 안정성을 향상시키기 위해 L-아스코르브산-6-팔미테이트, L-아스코르브산 6-포스페이트 및 L-아스코르브산 2-글루코시다아제와 같은 안정적인 아스코르브산 유도체를 생성하기 위해 아스코르브산 분자에 일부 변형이 이루어졌습니다. 모 화합물보다 더 안정적임에도 불구하고 직접적인 항산화 활성을 갖지 않으며 생체 내에서 L-아스코르브산으로의 효소 전환이 필요합니다. 국소적으로 사용하는 경우, 이들 유도체는 모화합물인 아스코르브산에 비해 피부를 통한 투과성이 낮습니다[ 111 ].
권장 복용량에서 아스코르브산은 건강한 개인에게 안전합니다. 비타민 C의 일일 권장 섭취량은 약 100mg입니다. 그러나 중증 환자의 경우 비타민 C 투여는 여전히 우려되는 문제이다[ 122 ].
일일 섭취량이 2g/일을 초과하면 옥살산염 결정 신장병증을 유발할 수 있다는 사례가 문서화되었습니다. 어떤 경우에는 하루 480mg 정도의 낮은 경구 섭취 또는 45mg의 단회 정맥 투여로 옥살산염 결정 신장병증을 유발할 수 있다는 사실도 관찰되었습니다[ 123 ]. 신장 결석 병력이 있는 개인의 경우 하루 1g보다 많은 양을 섭취하면 신장 결석 재발 위험이 크게 높아집니다[ 124 ]. 대사 과정에서 아스코르브산은 조직에서 데하이드로아스코르빈산으로 분해된 다음 디케토굴론산으로 분해되고 궁극적으로 옥살산염으로 분해되어 소변으로 배설됩니다. [ 125 ] 세뇨관의 과포화 옥살산염은 결정으로 침착되어 결석으로 발전하여 세뇨관 상피를 손상시킵니다[ 122 , 123 ]. 아스코르브산 유발 옥살산 신장병증은 장기간 투석이나 이식이 필요한 만성 신장 질환, 심지어 사망까지 포함하여 심각한 결과를 초래할 수 있습니다 [ 123 ]. 기저 질환이 있는 환자가 섭취한 아스코르빈산의 기간과 용량은 급성 신장 손상의 발병에 영향을 미칩니다.
전 세계적으로 아스코르빈산 시장은 2020년에 1억 2,730만 달러 규모로 평가되었으며, 2020년부터 2027년까지 연평균 4.6%의 성장률로 확장될 것으로 예상됩니다[ 126 ]. 2016년 보고서에 따르면 제약 산업은 아스코르브산 전체 수요의 약 30%를 차지했습니다[ 127 ].
9. 향후 전망 및 결론
암은 전 세계적으로 두 번째로 큰 사망 원인이며, 이 치명적인 질병을 해결하기 위해 수많은 접근법과 자료가 연구되고 있습니다. 이러한 맥락에서 최근 아스코르빈산이 유망한 후보로 떠올랐습니다. 위에서 다룬 아스코르브산의 잠재적인 기능은 효과적인 분포를 통해 종양 환경에서 아스코르브산이 종양 세포와 충분히 접촉하는 것과 관련이 있습니다[ 59 ]. 따라서 항암 효과를 발휘하기 위해서는 고용량의 아스코르빈산이 중요합니다. 그러나 암 치료를 위한 보편적인 모델로 간주되어서는 안 됩니다[ 66 ]. 경구 및 정맥 투여로 인해 혈장 약동학이 다르기 때문에 종양 세포로의 아스코르베이트 분포의 약동학을 이해하는 것은 임상 시험 계획 및 새로운 아스코르베이트 치료에 대한 지원에 필수적입니다[ 76 ] . 암 환자에 대한 수많은 사례 연구와 임상 시험에서는 고용량의 아스코르빈산을 단독으로 또는 화학 요법과 병용하여 독성을 줄이면서 삶의 질을 향상시키는 것으로 나타났습니다 [ 128 , 129 ]. 비타민 C는 HIF, GLUT1 [ 46 , 59 , 66 ] 및 TET [ 130 , 131 ] 와 같은 다양한 취약한 림프절을 표적으로 삼아 암 진행을 방해합니다 . 오랫동안 아스코르브산과 그 유도체는 잠재적인 항암제로 논란의 여지가 있었습니다. Wang 등은 위암 및 전이성 대장암 환자를 대상으로 한 1상 임상 연구에서 다른 항암제와 함께 고용량의 아스코르브산을 투여하면 부작용이 적절히 감소되어 잠재적으로 효능이 향상되어 환자의 삶의 질이 향상된다는 사실을 관찰했습니다 . ]. Lv 등은 수술 후 간세포암종 환자에 대한 후향적 연구에서 정맥 내 아스코르브산 투여가 무병 생존 기간을 연장시키는 것을 관찰했습니다[ 133 ]. Zhao 등은 급성 골수성 백혈병 노인 환자를 대상으로 한 임상 연구에서 아스코르빈산을 다른 항암제와 병용했을 때 항암제만 단독으로 사용한 경우에 비해 실질적인 독성 없이 완전관해(CR) 및 전체 생존율이 더 높았다는 사실을 목격했습니다. 134 ]. Macan 등은 6-(1,2,3-트리아졸릴)-2,3-디벤질-L-아스코르브산 유사체의 두 가지 서열을 개발했는데, 이는 정상 섬유아세포에 대한 실질적인 독성 없이 유방 선암종 세포주에 대해 강력한 세포 증식 억제 활성을 나타냈습니다. [ 90]. 유사하게, Harej 등은 참조 화합물 중 하나인 카르복시아미도트리아졸보다 더 큰 세포독성을 갖고 유방 선암종 세포에 대해 가장 높은 항증식 활성을 나타내는 새로운 4-치환 1,2,3-트리아졸 L-아스코르브산 유사체를 개발했습니다[ 91 ].
현재 여러 전임상 및 임상 시험에서는 비경구 아스코르베이트가 아무런 간섭 없이 화학 요법 또는 방사선 요법과 시너지 효과를 발휘하여 [ 135 , 136 , 137 ] 결과적으로 정상 조직을 손상으로부터 보호함으로써 암 환자의 삶의 질을 향상시키는 능력이 있음을 지적했습니다. 화학 요법으로 [ 138 ]. 따라서 고용량 정맥내 아스코르베이트 및 그 유도체는 항암 요법에 대한 저렴한 대안을 의미합니다. 또한 독성이 낮고 가용성이 높으며 비용이 저렴하기 때문에 단독으로 또는 병용하여 임상 시험에서 잠재적인 항암제로서 추가로 탐구되어야 합니다.
아스코르빈산의 항암 잠재력은 반세기 전에 보고되었지만 항암 활성과 관련된 메커니즘의 대부분은 아직까지 불분명한 상태로 남아 있습니다. 그러나 최근 몇 년간의 일부 연구 결과는 항암제로서 암 치료에 아스코르베이트가 관여하는 생물학적 기능과 메커니즘에 대한 우리의 이해를 넓혔으며, 이는 암 치료에 아스코르베이트를 사용하는 데 대한 좋은 근거가 있음을 시사하는 흥미롭고 유망한 다양한 가설을 강조했습니다. . 아스코르빈산은 암 발생 및 진행에 근본적으로 관여하는 HIF, TET, GLUT-1, FIH 및 PHD의 기능에 중요한 역할을 합니다. 아스코르브산에 의해 조절되는 경로를 발견하면 종양을 아스코르브산 사용에 민감하게 만드는 혁신적인 치료법 개발의 진전이 촉진될 것입니다. 우리는 항암제로서 보고된 새로운 아스코르빈산 유도체 중 일부를 검토한 결과, 일부 유도체는 정상 인간 세포에 대한 독성이 낮거나 독성이 없는 실험에 사용된 표준 약물과 유사하다는 것이 관찰되었습니다.
고용량 정맥내 아스코르베이트 및 그 유도체는 더 연구되어야 할 유리하고 경제적인 항암 치료 기회를 제공할 수 있는 잠재력을 가지고 있습니다. 자연에서 쉽게 구할 수 있고 독성이 낮으며 비용이 저렴하기 때문에 아스코르브산과 그 파생물은 암과의 전쟁에서 중요한 치료 옵션이 될 수 있습니다. 그러나 암 치료에서 아스코르브산의 임상적 이점에 대한 결정적인 답변을 추구해야 합니다.
약어
| 과다 | 포도당 수송체 |
| HIF | 저산소증 유발 인자 |
| TET | 텐-일레븐 전위 |
| 그 안에 | HIF를 억제하는 요인 |
| PHD | 프롤릴 수산화효소 도메인 효소 |
| VHL | 히펠-린다우 출신 |
| DHA | 탈수소아스코르베이트 |
| 나드프 | 니코틴아미드 아데닌 디뉴클레오티드 인산염 |
| GSH | 글루타티온 |
| GSSG | 글루타티온 이황화물 |
| NADP | 니코틴아미드 아데닌 디뉴클레오티드 인산염 |
| 파르프 | 폴리(ADP-리보스) 중합효소 |
| 그들 | 니코틴아미드 아데닌 디뉴클레오티드 |
| 갭DH | 글리세르알데히드 3-인산염 탈수소효소 |
| 남성 | 니코틴아미드 |
| 5mC | 5-메틸시토신 |
| 5hmC | 5-히드록시메틸시토신 |
| 5fC | 5-포밀시토신 |
| 5CaC | 5-카르복실시토신 |
| AML | 급성 골수성 백혈병 |
| CMML | 만성 골수단구성 백혈병 |
| Fe 2+ /α-KGDD | 철/α-케토글루타레이트 의존성 이산화효소 |
| 로스 | 활성산소종 |
| HNE | 4-히드록시노네날 |
| AscH− | 아스코르베이트 |
| 오름차순⋅− | 아스코르베이트 자유 라디칼 |
| H2O2 | 과산화수소 |
| HO⋅ | 하이드록실 퍼옥사이드 라디칼 |
| MTX | 미톡산트론 |
| 잘 | 팔미토일아스코르베이트 |
| DOX | 독소루비신 |
| DC | 도세탁셀 |
| 그리고 | 에피루비신 |
| PTX | 파클리탁셀 |
| 그는 가지고있다 | 투과전자현미경 |
| SLN | 고체지질나노입자 |
| DLS | 동적 광산란 |
| DHC | 트랜스-디히드로크로토닌 |
| AAS | L-아스코르빈산 6-스테아레이트 |
| 5-FU | 5-플루오로우라실 |
저자 기여
JR, JM, PCS, VKT가 컨셉화에 참여했습니다. JR은 문헌 검토를 수행하고 원고 초안을 작성했습니다. JM, VKT 및 PCS는 원고를 광범위하게 수정하고 중요한 수정을 제공하며 최종 원고에 기여했습니다. 모든 저자는 출판된 원고 버전을 읽고 이에 동의했습니다.
| 번호 | 분류 | 제목 | 조회 수 | 추천 수 | 날짜 |
|---|---|---|---|---|---|
| 공지 | 전문정보 |
pubmed 의학/약학 논문 전문사이트
|
1423 | 0 | 2024.04.01 |
| 공지 | 🚨(뉴비필독) 전체공지 & 포인트안내 22 | 29308 | 64 | 2024.11.04 | |
| 공지 | URL만 붙여넣으면 끝! 임베드 기능 | 23238 | 44 | 2025.01.21 | |
| 475 | 잡담 | 과자 고르듯이 약을... 창고형 약국 인기에 약사들 반발 3 | 1170 | 0 | 2025.06.19 |
| 474 | 잡담 |
국내 첫 '마트형 약국' 등장에…동네 약국들은 긴장
3 |
1195 | 0 | 2025.06.19 |
| 473 | 잡담 | 후두암의 초기 증상과 원인, 대처 방법 완벽 가이드 1 | 621 | 0 | 2025.05.09 |
| 472 | 잡담 | 외이도염 초기증상과 원인, 두통 대처법 총정리 | 593 | 0 | 2025.05.09 |
| 471 | 잡담 | 장꼬임(장폐색) 증상과 치료 방법 알아보기 1 | 611 | 0 | 2025.05.09 |
| 470 | 잡담 | 소화불량 증상과 소화에 좋은 음식 1 | 569 | 0 | 2025.05.09 |
| 469 | 잡담 | LDL 콜레스테롤을 낮추는 음식과 정상수치 가이드 | 624 | 0 | 2025.05.09 |
| 468 | 잡담 |
다들 제발제발제발 이 3개만 매일 해줘... 진짜 삶이 달라진다
|
577 | 0 | 2025.05.09 |
| 467 | 잡담 | 너무아파서 자다깼는데 근육통에 무슨약이 잘들어? 2 | 589 | 0 | 2025.03.19 |
| 466 | 잡담 |
약사가 실제로 먹고 효과 본 영양제 조합! 눈 피로, 근육통, 장 건강부터 암 예방까지
|
9970 | 0 | 2025.03.07 |
| 465 | 잡담 |
다이소 영양제 총정리: 가성비 좋은 제품 vs. 돈값 안 하는 제품
|
9906 | 0 | 2025.03.07 |
| 464 | 잡담 |
Vitamin B-Complex (Pure vs Thorne) 총평
1 |
10007 | 0 | 2025.03.05 |
| 463 | 잡담 | 장누수,피부트러블,두피염,무좀 다 말살시킴 1 | 9962 | 0 | 2025.03.05 |
| 462 | 잡담 | 영양제 26종 챙겨먹는 사람인데 | 9717 | 0 | 2025.03.05 |
| 461 | 잡담 |
레이 커즈와일 평소 사진.jpg
|
9774 | 0 | 2025.03.05 |
| 460 | 잡담 | 여드름쟁이들 보시길 | 9755 | 0 | 2025.03.05 |
| 459 | 잡담 |
항산화제의 두얼굴 그리고 근육키우기
|
9931 | 0 | 2025.03.05 |
| 458 | 정보📰 |
OptiMSM Flake 와 Powder 차이에 관한 제품 설명
|
9774 | 0 | 2025.03.05 |
| 457 | 잡담 |
오메가3 ALA -> EPA DHA 전환률
3 |
9816 | 0 | 2025.03.05 |
| 456 | 잡담 |
다이소 건기식 철수는 진짜 약사들의 집단 이기주의다
|
9768 | 0 | 2025.03.05 |
| 455 | 잡담 |
다이소 영양제 목록 (4)
|
9733 | 0 | 2025.03.05 |
| 454 | 잡담 |
다이소 영양제 목록 (3)
|
10020 | 0 | 2025.03.05 |
| 453 | 잡담 |
다이소 영양제 목록 (2)
|
9928 | 0 | 2025.03.05 |
| 452 | 정보📰 |
다이소 영양제 목록 (1)
|
9885 | 0 | 2025.03.05 |
| 451 | 잡담 |
대한약사회에서 입장문 발표햇엇네
1 |
9865 | 0 | 2025.03.05 |
| 450 | 잡담 |
요즘 핫하다는 다이소 영양제 찐 약사가 리뷰 했던데
1 |
9810 | 0 | 2025.03.05 |
| 449 | 잡담 |
다이소 영양제 판매 근황
|
9813 | 0 | 2025.03.05 |
| 448 | 잡담 |
다이소에서 파는...영양제 종류 ㄹㅇ...jpg
|
9780 | 0 | 2025.03.05 |
| 447 | 잡담 |
요즘 독감이 유행이라던데...🤧 명의가 알려주는 감기와 독감의 차이 #명의 #독감 #감기
|
357 | 0 | 2025.01.22 |
| 446 | 잡담 |
제로콜라 의학리뷰: 과연 문제가 있을까요 없을까요?
|
3273 | 0 | 2024.12.01 |